摘要 恶臭假单胞菌NCIMB 9866利用对甲苯酚或2,4-二甲苯作为唯一碳源和能源。催化对甲苯酚对甲基氧化的酶已被详细研究,但负责2,4-二甲苯分解代谢中对甲基氧化的酶尚未报道。本研究通过实时定量PCR分析表明,对甲苯酚分解代谢中编码对甲苯酚甲基羟化酶(PCMH)的pchC和pchF基因以及编码对羟基苯甲醛脱氢酶(PHBDD)的pchA基因可能也参与2,4-二甲苯的分解代谢。酶活性测定和中间体鉴定表明,PCMH和PHBDD分别催化2,4-二甲苯氧化为4-羟基-3-甲基苯甲醛和4-羟基-3-甲基苯甲醛氧化为4-羟基-3-甲基苯甲酸。此外,通过基因敲除和互补实验发现,编码PCMH的基因pchF对2,4-二甲苯分解代谢是必需的,而编码PHBDD的基因pchA不是分解代谢所必需的。对基因敲除菌株对不同中间体的最大比生长速率和比活性分析表明,菌株9866中存在其他具有PHBDD活性的酶,但PHBDD在2,4-二甲苯分解代谢中起主要作用。
引言
2,4-二甲苯,也称为2,4-二甲基苯酚,是煤气工业的副产品。由于其环境毒性,它被美国环境保护署列入优先污染物清单。至今,两种细菌菌株,恶臭假单胞菌NCIMB 9866和副球菌属菌株U120,被报道能完全降解这种环境污染物。在恶臭假单胞菌NCIMB 9866中,2,4-二甲苯分解代谢起始于对甲基氧化为羧基,通过两个推定中间体4-羟基-3-甲基苄醇和4-羟基-3-甲基苯甲醛形成4-羟基-3-甲基苯甲酸;随后4-羟基-3-甲基苯甲酸中的邻甲基也被氧化为羧基,通过其相应的醇和醛中间体,产生4-羟基异酞酸;4-羟基异酞酸转化为原儿茶酸(PCA),进入邻位开环途径进行进一步代谢(图1a)。该菌株中参与2,4-二甲苯分解代谢的两种酶,4-羟基-3-甲基苯甲酸羟化酶和4-羟基异酞酸羟化酶,已被纯化和表征;但其编码基因尚未报道。
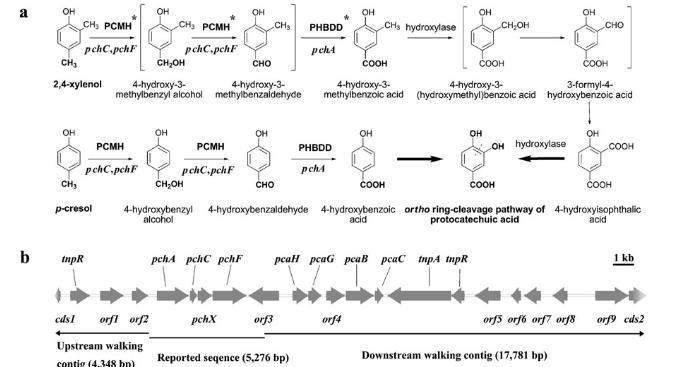
图1 a 恶臭假单胞菌NCIMB 9866中2,4-二甲酚和对甲酚的推定代谢途径(Chapman和Hopper 1968;Cronin等1999;El-Mansi和Hopper 1990;Elmorsi和Hopper 1977;Kim等1994),以及本研究提出的由pchC和pchF编码的PCMH及pchA编码的对羟基苯甲醛脱氢酶(PHBDD)催化的代谢反应(标有星号)。b 通过从已报道基因双向基因组步移获得的基因簇结构
菌株9866也利用对甲苯酚,其分解代谢同样起始于对甲基氧化为羧基,通过两个中间体4-羟基苄醇和4-羟基苯甲醛形成4-羟基苯甲酸,最终在4-羟基苯甲酸直接转化为PCA后进入PCA的邻位开环途径(图1a)。来自85-kb质粒pRA4000的一个5,276-bp DNA序列携带pchA、pchC和pchF基因已被测定(图1b)。纯化的pchC和pchF编码的PCMH被证明催化对甲苯酚的两个脱氢反应生成相应的醇和醛。pchA编码的PHBDD被证实催化NADP+依赖的4-羟基苯甲醛氧化为4-羟基苯甲酸。尽管PCMH也被显示对2,4-二甲苯有催化活性,但其可能产物未被鉴定,且其在2,4-二甲苯分解代谢中的生理作用未在体内验证。因此,探究负责对甲苯酚初始氧化的酶是否也参与2,4-二甲苯氧化将是有趣的。此外,尚未有酶被报道负责2,4-二甲苯初始氧化中4-羟基-3-甲基苯甲醛氧化为4-羟基-3-甲基苯甲酸。本研究中,我们报道菌株9866中2,4-二甲苯和对甲苯酚的分解代谢在对甲基氧化中共享相同的酶。
材料与方法
细菌菌株、质粒、引物、化学品、培养基和培养条件
使用的细菌菌株和质粒见表1,引物见表S1。假单胞菌菌株在30°C于最小培养基中与不同碳源一起培养。大肠杆菌菌株在37°C于溶菌肉汤(LB)中培养。抗生素在必要时以100μg/ml氨苄青霉素钠、50μg/ml硫酸卡那霉素或20μg/ml盐酸四环素的浓度添加到培养基中。所有试剂购自Sigma Chemical Co.或Fluka Chemical Co.。
| 菌株或质粒 | 特性或目的 | 参考文献或来源 |
|---|---|---|
| 恶臭假单胞菌NCIMB 9866 | 野生型菌株,表型为2,4-二甲苯+和对甲苯酚+, AmpR, KanS, TcS | Chapman and Hopper (1968) |
| 9866△pchA | NCIMB 9866突变体,pchA基因被来自质粒pTnMod-Okm的卡那霉素抗性基因替换, AmpR, KanR | 本研究 |
| 9866△pchA[pRK415-pchA] | pchA基因通过pRK415-pchA在9866△pchA中互补, AmpR, KanR, TcR | 本研究 |
| 9866△pchF | NCIMB 9866突变体,pchF基因被来自质粒pTnMod-Okm的卡那霉素抗性基因替换, AmpR, KanR | 本研究 |
| 9866△pchF[pRK415-pchF] | pchF基因通过pRK415-pchF在9866△pchF中互补, AmpR, KanR, TcR | 本研究 |
| 大肠杆菌DH5a | F- φ80(lacZ)△M15 △lacX74 hsdR(rK- mK+) △recA1398 endA1 tonA | TransGen Biotech |
| 大肠杆菌BL21(DE3) | F- ompT hsdS(rB- mB-) gal dcm (DE3) | TransGen Biotech |
| 大肠杆菌WM3064 | 接合供体菌株,2,6-二氨基庚二酸营养缺陷型: thrB1004 pro thi rpsL hsdS lacZ△M15 RP4-1360 △(araBAD)567 △dapA1341::[erm pir(wt)] | Dehio and Meyer (1997), Saltikov and Newman (2003) |
| pET-28a(+) | 表达载体, KanR, C/N端His·Tag/凝血酶/T7·Tag, T7 lac启动子, T7转录起始, fl起源, lacI | Novagen |
| pEX18Tc | 基因敲除载体, oriT+, sacB+, TcR | Hoang et al. (1998) |
| pRK415 | 广宿主范围载体, TcR | Keen et al. (1988) |
| pTnMod-Okm | 卡那霉素抗性基因来源 | Dennis and Zylstra (1998) |
| pET-28a(+)-pchA | PHBDD表达载体,通过将pchA插入NcoI/HindIII限制位点,带有C端His·Tag | 本研究 |
| pET-28a(+)-pchFC | PCMH表达载体,通过克隆pchF和pchC到Ndel/HindIII限制位点,带有C端和N端His-Tag | 本研究 |
| pEX18Tc-pchA | pchA基因敲除载体,包含pchA上游和下游区域同源DNA片段及来自pTnMod-Okm的卡那霉素抗性基因 | 本研究 |
| pEX18Tc-pchF | pchF基因敲除载体,包含pchF上游和下游区域同源DNA片段及来自pTnMod-Okm的卡那霉素抗性基因 | 本研究 |
| pRK415-pchA | pchA基因互补载体,通过将pchA融合到pRK415的HindIII/EcoRI限制位点 | 本研究 |
| pRK415-pchF | pchF基因互补载体,通过将pchF融合到pRK415的HindIII/EcoRI限制位点 | 本研究 |
实时定量PCR
菌株9866在以2 mM葡萄糖为碳源的最小培养基中培养至OD600为0.1,然后用2 mM 2,4-二甲苯或对甲苯酚诱导5小时。总RNA使用RNAprep pure细菌试剂盒分离,并使用PrimeScript RT试剂盒与gDNA Eraser反转录为cDNA。实时定量PCR在CFX ConnectTM实时PCR检测系统上使用iQ SYBR Green Supermix与表S1中的引物进行。目标mRNA的量通过2−ΔΔCT方法相对于16S rRNA进行标准化。
基因克隆与表达、蛋白质纯化
从菌株9866基因组DNA PCR扩增的pchA经NcoI和HindIII消化后克隆到pET-28a(+)中,获得表达构建体pET-28a(+)-pchA;pchF和pchC扩增后与pET-28a(+)的Ndel/HindIII限制位点融合,使用NovoRec® PCR一步定向克隆试剂盒产生构建体pET-28a(+)-pchFC。
携带表达构建体的大肠杆菌BL21(DE3)菌株在37°C培养至OD600为0.5,然后在30°C用0.1 mM异丙基-β-D-硫代半乳糖苷诱导5小时。C端His标记的PchA(PchA-H6)和N端His标记的PchF(H6-PchF)/C端His标记的PchC(PchC-H6)从相应细胞提取物中通过Ni2+-NTA琼脂糖色谱法纯化。结合柱的蛋白质用结合缓冲液(PchA-H6为40 mM HEPES-KOH缓冲液pH 8.0,H6-PchF/PchC-H6为50 mM甘氨酸-NaOH缓冲液pH 9.0)含50和250 mM咪唑洗涤和洗脱。纯化的蛋白质对结合缓冲液透析,通过SDS-PAGE分析,然后储存于4°C。
相关新闻推荐
1、鸡大肠埃希氏菌裂解性噬菌体一步生长曲线、生物学特征及全基因组测序(一)
2、海洋来源氨基香豆素增强多粘菌素B抗伯克霍尔德菌活性(一)
