除艰难梭菌标准菌株(Cdiff_TS)外,所有细菌均在含葡萄糖的各自培养基中生长良好。然而,双歧杆菌标准菌株(Bbif_TS)、动物双歧杆菌乳亚种(B. lactis)Bi-07(Blac_Bi-07)、嗜酸乳杆菌标准菌株(Laci_TS)及短乳杆菌Lbr-35(Lbre_Lbr-35)相比其他研究菌株生长较弱。多数细菌在商业GOS培养基中生长良好,而HMOs DFL和2'-FL是最具选择性的碳水化合物利用来源,其次是3-FL。
| 碳水化合物 | Bimuno GOS | GOS-p |
|---|---|---|
| HPLC组分1:DP4和/或更高 | 9.9 | 18.4 |
| HPLC组分2:DP4和/或更高 | 16.3 | 31.5 |
| HPLC组分3:DP3 | 32.6 | 42.5 |
| HPLC组分4:DP2 | 35.8 | 7.7 |
| 葡萄糖 | 4.9 | 未检测到 |
| 半乳糖 | 0.5 | 未检测到 |
注:使用材料与方法部分描述的HPLC方法分析组成。结果以曲线下面积(面积%)给出,即峰面积相对于所有检测到的峰总面积的百分比。DP=聚合度;HPLC=高效液相色谱;GOS=低聚半乳糖;GOS-p=纯化的富含寡糖的低聚半乳糖。
双歧杆菌的生长。
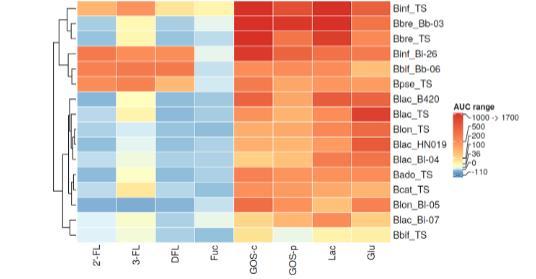
图2. 碳源对双歧杆菌生长的影响。通过生长曲线下面积(AUC)评估双歧杆菌在1% 2'-岩藻糖基乳糖(2'-FL)、3-岩藻糖基乳糖(3-FL)、二岩藻糖基乳糖(DFL)、岩藻糖(Fuc)、商业低聚半乳糖(GOS-c)、富集低聚糖的GOS(GOS-p)、乳糖(Lac)和葡萄糖(Glu)存在下的生长情况。AUC值通过减去细菌在未添加碳水化合物的生长培养基中培养的孔穴AUC值进行标准化。菌株根据相似生长模式进行聚类。AUC生长数据采用颜色编码,从深红色表示强烈生长(AUC 1000-1700;500-999;200-499;100-199;36-99;0-35)到深蓝色表示生长弱于基础培养基(AUC-110至-1)。所有菌株缩写列表参见表2。
所有双歧杆菌碳水化合物利用分析的结果以热图形式显示在图2中。此处,每种细菌的每种碳源的AUC值减去了相应未添加碳水化合物的培养基的AUC值。双歧杆菌菌株也根据其生长模式的相似性进行了聚类。图2-4中的生长强度通过颜色表示,范围从蓝色(表示生长低于生长培养基,AUC-110至-1)、无生长(AUC 0-35)、极弱生长(AUC 36-99)、弱生长(AUC 100-199)、生长(AUC 200-499)、强生长(AUC 500-999)到剧烈生长(AUC 1000-1700),用红色表示。
双歧杆菌拥有大量碳水化合物代谢基因库。HMOs的利用是将双歧杆菌分为两个主要簇的主要因素。在我们的研究中,婴儿双歧杆菌Bi-26、两歧双歧杆菌Bb-06(Bbif_Bib-06)和假小链双歧杆菌模式菌株(Bpse_TS),以及婴儿双歧杆菌模式菌株(Binf_TS,ATCC 15697),都能在2'-FL、3-FL和DFL上良好生长。此外,两种短双歧杆菌菌株也与上述菌株聚在一起,很可能是由于在GOS-c和乳糖上生长稳健,并且在3-FL上生长微弱。
婴儿双歧杆菌有几个ABC转运蛋白,其中两个(FL1-BP和FL2-BP)是将岩藻糖基化HMOs摄取到细胞内所必需的,在细胞内它们被细胞内的糖苷水解酶降解。糖苷水解酶GH29(1,3-和1,4-α-L-岩藻糖苷酶)和GH95(1,2-α-L-岩藻糖苷酶)对于将岩藻糖从岩藻糖基乳糖上分离是必需的。与先前的研究结果一致,我们的结果显示婴儿双歧杆菌模式菌株(Binf_TS)在岩藻糖基化HMOs作为唯一碳源时生长良好。婴儿双歧杆菌Bi-26(Binf_Bi-26)在2'-FL上的生长先前已有描述,在这里,我们也证实了该菌株在3-FL和DFL上的生长,正如先前观察到的。两歧双歧杆菌在细胞表面具有糖苷水解酶,使其能够细胞外降解HMOs和粘蛋白结构,导致单糖和二糖在细胞外水解,可能促进交叉喂养。两歧双歧杆菌也是双歧杆菌中少数能够利用粘蛋白的菌株之一。与Thongaram等人和Garrido等人的发现相似,两歧双歧杆菌模式菌株(Bbif TS)在我们的实验中未在任何测试的HMOs上生长,并且碳源上的总体生长较弱。然而,益生菌两歧双歧杆菌菌株Bb-06(Bbif_Bib-06)在2'-FL、3-FL和DFL上生长良好,这一特性先前在其他两歧双歧杆菌菌株中也得到证实。
岩藻糖基化HMOs的转运蛋白以及降解它们所必需的糖苷水解酶可以在一些(10%)但非所有研究的假小链双歧杆菌菌株中找到。我们在此研究的假小链双歧杆菌模式菌株(Bpsa_TS)在岩藻糖基化HMOs上生长良好,并且其基因组包含一个a-L-岩藻糖苷酶基因。短双歧杆菌菌株已被报道含有GH95 a-L-岩藻糖苷酶;然而,它们通常也需要GH29才能在岩藻糖基化HMOs上生长。
短双歧杆菌菌株在乳糖-N-四糖和LNnT上表现出一致的生长,而在岩藻糖基化HMOs上的生长似乎是菌株特异性的。我们在此研究的短双歧杆菌模式菌株(Bbre_TS)和菌株Bb-03(Bbre_Bb-03)未在2'-FL或DFL上生长,尽管在3-FL上观察到轻微生长。在这项研究中,我们逐一评估了细菌菌株的生长,这为在更复杂的细菌群落中HMOs的利用提供了指示。Lawson等人最近研究了婴儿双歧杆菌分离株对HMOs的利用,发现一些能够利用HMOs的菌株可以通过交叉喂养促进不能利用HMOs的菌株的生长。因此,由于不同双歧杆菌之间HMOs利用模式的差异,更复杂的细菌群落可能会被改变。
属于青春双歧杆菌、短双歧杆菌、乳双歧杆菌、链状双歧杆菌和长双歧杆菌的其他11种双歧杆菌菌株均不能在2'-FL、DFL或岩藻糖上生长,但它们在GOS(商业和纯化形式)、葡萄糖和乳糖上生长良好。长双歧杆菌模式菌株和益生菌长双歧杆菌菌株Bl-05(Blon_Bl-05)未在3-FL上生长,而在青春双歧杆菌、乳双歧杆菌和链状双歧杆菌菌株中观察到3-FL上的轻微生长。3-FL测试产品包含2.5%的乳糖,而2'-FL和DFL的HMO含量均高于99%,这可能影响了结果,因为乳糖是比岩藻糖基化HMOs更容易发酵的糖。然而,这种现象在所研究的细菌菌株中并不一致。
在早期的一项研究中,双歧杆菌物种和菌株对两种GOS产品及其商业和纯化版本的利用方式不同。在不同长度、糖苷键和分支的GOS结构利用方面,已发现菌株依赖性差异。此外,青春双歧杆菌、婴儿双歧杆菌和乳双歧杆菌已被证明对不同GOS结构的利用方式不同。在我们的研究中,所有双歧杆菌在两种GOS产品上都生长相对良好;然而,GOS-c和GOS-p之间的生长存在一些小的菌株依赖性差异。类似地,Watson等人发现GOS支持大多数所研究双歧杆菌的生长。
葡萄糖、乳糖和GOS在所研究的双歧杆菌中被广泛利用,这与岩藻糖不同,后者通常不被双歧杆菌利用。此外,我们的数据支持了先前关于HMOs利用在双歧杆菌属中具有高度选择性的发现。
相关新闻推荐
1、江米酒曲中高产凝乳酶菌筛选、生长曲线及凝乳活力及蛋白水解活力测定(一)
