2.2.肽合成
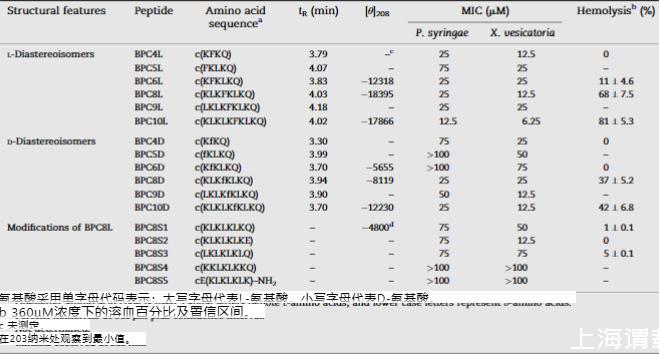
表1所列环肽通过在线性序列固相合成后进行灯上环化制备,如前所述。使用了三维正交Fmoc/tbutyl/allyl策略。Lys的侧链保护为叔丁氧羰基。引入Fmoc-Glu-OAl残基作为三功能氨基酸,允许肽锚定在灯上,这导致从固相支持物上裂解肽后产生Gln。通过用哌啶-CH2Cl2-NMP处理去除Fmoc保护基。Fmoc-氨基酸的偶联由HBTU和DIEA在NMP中介导24小时。通过将灯浸入NMP和CH2Cl2中进行洗涤。通过重复的Fmoc基团去除、偶联和洗涤循环进行肽延伸。一旦偶联步骤完成,通过用Pd在CHCl3-HOAc-NMM中在氮气下处理6小时裂解C末端烯丙酯,然后用CHCl3-HOAc-NMM、DIEA-CH2Cl2、NMP中的sodium N,N-diethyldithiocarbamate、NMP和CH2Cl2洗涤。通过最终Fmoc去除获得线性肽。通过用PyBOP、HOBt和DIEA在NMP中在微波照射下处理来自灯的五个堆叠盘进行环化。所有微波实验均使用配备双磁控管系统的微波Ethos SEL实验室站进行。实验时间、温度和功率通过EasyControl软件包控制。通过浸入标准Milestone参考容器中的ATC-400FO自动光纤温度控制系统监测温度。照射期结束后,去除溶剂,并用NMP和CH2Cl2洗涤灯。通过用TFA-H2O-TIS处理1小时进行相应线性和环肽的裂解,裂解混合物在N2流下蒸发至干。随后进行Et2O萃取,将化合物溶解在H2O中,冻干,通过HPLC分析纯度,并通过电喷雾电离质谱和/或快原子轰击质谱进行表征。
2.3.细菌菌株和培养基
使用以下植物病原细菌菌株:解淀粉欧文氏菌PMV6076、丁香假单胞菌致病变种EPS94和辣椒斑点病菌2133-2。所有细菌储存在补充有甘油的液体LB培养基中,并在-80°C下保存。解淀粉欧氏菌PMV6076和丁香假单胞菌致病变种EPS94在25°C下生长24小时后从LB琼脂上刮下,辣椒斑点病菌2133-2在25°C下生长48小时后刮下。将细胞材料悬浮在无菌水中,并使用针对这些菌株的活菌数与600 nm吸光度曲线将浓度调节至10^8 CFU mL-1。
2.4.抗菌活性
将冻干肽溶解在无菌milli-Q水中,终浓度为1 mM,并通过0.22μm孔径过滤器过滤除菌。对于MIC评估,对合成肽进行稀释以获得750、500、250、125和62.5μM的最终浓度。将每种稀释液的20μL在微量滴定板孔中与20μL相应的细菌指示剂悬浮液、160μL胰蛋白酶大豆肉汤混合,总体积为200μL。每个菌株、肽和浓度使用三个重复。阳性对照包含水而不是肽,阴性对照包含不含细菌悬浮液的肽。通过600 nm光密度测量自动测定微生物生长((Bioscreen C型仪器,芬兰Labsystem公司))。将微量板在25°C下孵育,每小时测量吸光度前摇动20秒。每个实验重复两次。MIC取实验结束时无生长的最低肽浓度。
2.5.溶血活性
通过测定新鲜人血红细胞悬浮液的血红蛋白释放来评估肽的溶血活性。使用含EDTA的BD vacutainer K2E系统无菌采集血液,并在4°C下储存少于2小时。将血液以6000 x g离心5分钟,用Tris缓冲液洗涤三次,并用Tris缓冲液稀释。将肽溶解在Tris缓冲液中,终浓度为720、480、240和120μM。每个肽和浓度使用三个重复。将65微升人红细胞与65微升肽溶液在MicroAmp®96孔板中混合,并在37°C下连续摇动孵育1小时。然后,将板以3500xg离心10分钟。将80微升等分试样的上清液转移至100孔微量板(Bioscreen),并用80微升milli-Q水稀释。使用Bioscreen微生物生长曲线分析仪在540 nm处测量溶血度。在Tris缓冲液中加入蜂毒肽作为阳性对照测定完全溶血。溶血百分比使用公式计算:H=100 x,其中Op是给定肽浓度的密度,Ob是缓冲液的密度,Om是蜂毒肽阳性对照的密度。
2.6.杀菌活性分析
测定了肽BPC10L、BPC10D、BPC6L和BPC6D的杀菌活性。将接种浓度为4x10^7 CFU mL-1的LB肉汤培养物在相应肽的60μM浓度下孵育。在6.5小时内的不同时间间隔取出500μL等分试样,进行10倍稀释,并将稀释液铺在辣椒斑点病菌的LB琼脂平板和丁香假单胞菌的King B琼脂平板上。在25°C孵育48小时后计数菌落形成单位。数值表示为从实验开始时的存活百分比。
2.7.反相高效液相色谱分析
使用分析型C18 Kromasil柱对每种肽进行RP-HPLC分析。使用0-100%CH3CN的线性梯度在0.1%TFA中以1.0 mL/min的流速洗脱肽超过7分钟。在220 nm处测量吸光度。当峰达到最大高度时确定每种肽的RP-HPLC保留时间。
2.8.对蛋白酶降解的敏感性
通过用100mM Tris缓冲液中的1μg/mL蛋白酶K处理50μg/mL肽,在室温下进行BPC10L、BPC10D及其相应线性肽的消化。通过上述RP-HPLC监测5、10、15、20、30、45和60分钟后的肽裂解。根据天然肽RP-HPLC峰面积的减少计算降解百分比来估计消化程度。
2.9.圆二色光谱
使用Jasco分光偏振计在25°C下获得圆二色光谱测量值。在190-250 nm波长范围内,以0.1 nm间隔、50 nm/min速度、0.5秒响应时间和1 nm带宽,在1 mm路径长度的熔融石英池中获得光谱。将肽溶解在pH 7.4的10 mM磷酸钠缓冲液中的0-100%TFE中,浓度为200μM。使用仅含溶剂的池进行基线校正。数据以平均残基椭圆度的形式表示,按存在于不同肽中的总酰胺基的摩尔数计算。
相关新闻推荐
2、结核分枝杆菌通过分泌D-丝氨酸抑制T细胞功能实现免疫逃逸(二)
3、基于β-半乳糖苷酶Lac Z的UPR响应指示菌株的构建及生长曲线测定——讨论
