硝酸盐被完全消耗(图4a–c)。当使用硝酸盐时,除DnapB菌株外,所有napAt菌株的硝酸盐还原动力学和速率均相同(表3)。DnapB菌株的硝酸盐还原速率比其他napAt菌株慢约15%(图4a)。特别值得注意的是,DnapBDnrfA菌株的硝酸盐还原速率与野生型相当(图4a)。出乎意料的是,DnapB菌株与所有napA菌株均未检测到亚硝酸盐(图4b)。然而,铵离子在DnapB菌株中比野生型更早达到可检测水平,并最终积累至与野生型相同的浓度(图4c)。这一结果表明,DnapB菌株在生长早期较高的生物量可能源于其缺乏亚硝酸盐毒性。此外,野生型的亚硝酸盐还原速率高于硝酸盐。当使用亚硝酸盐时,除缺乏NrfA的菌株外,所有菌株的亚硝酸盐还原速率相同,包括DnapB菌株——当以硝酸盐作为唯一电子受体时,该菌株的亚硝酸盐还原速率无法评估(表3)(图4d)。
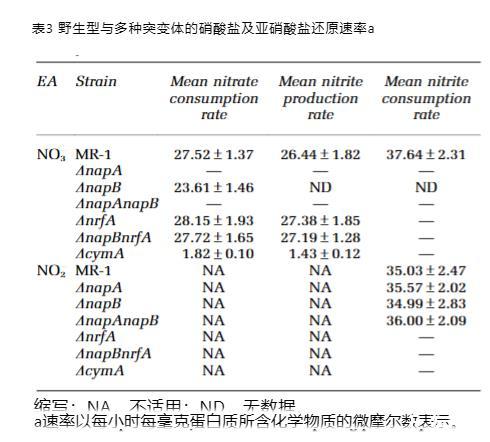
该结果表明,亚硝酸盐向铵离子的转化速率高于硝酸盐向亚硝酸盐的转化速率,这解释了为何在使用硝酸盐时,DnapB培养物中亚硝酸盐浓度低于可检测水平。此外,对DcymA培养样本的IC分析证实,该菌株确实保留了还原硝酸盐的能力,尽管极其微弱,但完全无法还原亚硝酸盐(图4a-d)。
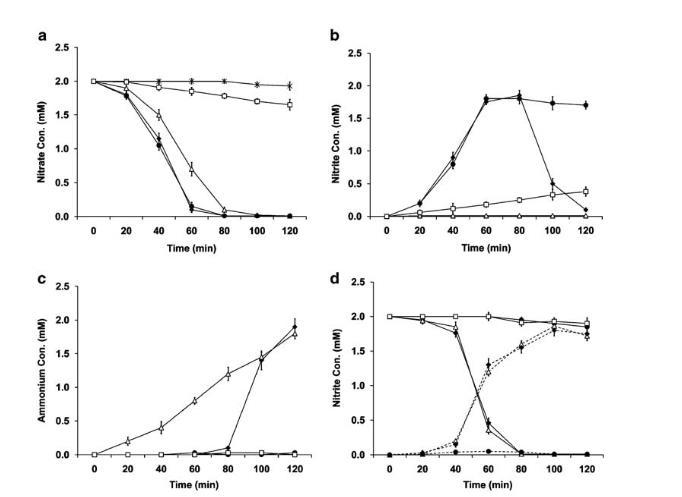
图4 野生型与突变株全细胞的硝酸盐和亚硝酸盐还原活性。所有分图中,MR-1(◆)、ΔnrfA(●)和ΔnapB(△)为共有菌株。ABC三个分图数据均取自2 mM硝酸盐的同一组样本,为清晰起见分三图展示。(a) 通过离子色谱法(IC)测定反应介质中硝酸盐的消失量。除共有菌株外,本图包含ΔnapA(*)和ΔcymA(□)。本图中ΔnapAΔnapB=ΔnapA且ΔnapBΔnrfA=ΔnrfA,故为清晰起见省略ΔnapAΔnapB和ΔnapBΔnrfA。(b) 通过IC测定反应介质中亚硝酸盐的生成量。除共有菌株外,本图包含ΔcymA(□)。本图中ΔnapAΔnapB与ΔnapA均无法产生硝酸盐,且ΔnapBΔnrfA=ΔnrfA,故为清晰起见省略ΔnapAΔnapB、ΔnapA和ΔnapBΔnrfA。(c) 通过IC测定反应介质中铵的生成量。除共有菌株外,本图包含ΔcymA(□)。本图中ΔnapAΔnapB=ΔnapA=ΔnapfA=ΔnapBΔnrfA=ΔcymA。(d) 通过IC测定2 mM亚硝酸盐反应介质中亚硝酸盐的消失量(实线)与铵的生成量(虚线)。除共有菌株外,本图包含ΔcymA(□)。本图中ΔnapAΔnapB=ΔnapA且ΔnrfA=ΔnapBΔnrfA=ΔcymA。所有实验均进行三次重复,误差线表示与均值的标准偏差。
综上所述,可以明确一氧化氮还原菌S.oneidensis的亚硝酸盐还原作用不依赖于NapA或NapB,这排除了NapB能够同时与氧化还原酶NapA和NrfA协同作用的可能性。NapB为S.oneidensis的硝酸盐还原提供了适应性优势。尽管在硝酸盐培养基上生长的DnapB菌株表现出显著的生物量增加,但其硝酸盐还原速率低于野生型。竞争实验已被广泛用于确定生物体是否从基因组中的某个基因中获益,特别是在该基因缺失不会引发显著表型的情况下(Winzeler等,1999;Giaever等,2002)。为验证NapB是否在硝酸盐条件下促进细菌生长,我们对野生型与DnapB菌株进行了竞争实验。
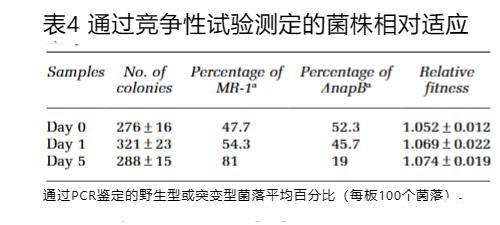
菌株筛选结果如表4所示。初始样本(T0)中,菌落平均数量为276个,经菌落PCR鉴定(每板检测100个菌落)确认野生型占47.7%。经过1天竞争后,野生型比例上升至54.3%。持续5天后,野生型占比达到81%。T1与T0、T5与T0、T5与T1的相对适应度值分别为1.052、1.069和1.074。该结果表明,NapB基因使奥奈德斯链霉菌在利用硝酸盐时获得了适应度优势。
尽管Shewanella oneidensis细胞能够利用NAP和NRF进行两步过程将硝酸盐还原为亚硝酸盐,再将亚硝酸盐还原为铵,但这两个系统都是非典型的,缺失了膜结合组分NAP的NapC和NRF的NrfH。在本研究中,我们验证了CymA通过NapB或直接向NapA以及向NrfA传递电子,从而完善了这两个系统。有趣的是,框内缺失cymA的菌株仍然保留了明显的将硝酸盐还原为亚硝酸盐的能力。一致地,一个在甲基萘醌合成中有缺陷的S.oneidensis△menC菌株,尽管能力受损,但能够在硝酸盐上生长。相反,在存在氧化锰(MnO2)、富马酸盐、硫代硫酸盐、亚硫酸盐、二甲亚砜或水铁矿(Fe(OH)3)的情况下,生长没有发生。
当NrfA不可用时,无论NapB是否存在,来自CymA的电子在NapA和NrfA之间的竞争都会崩溃。
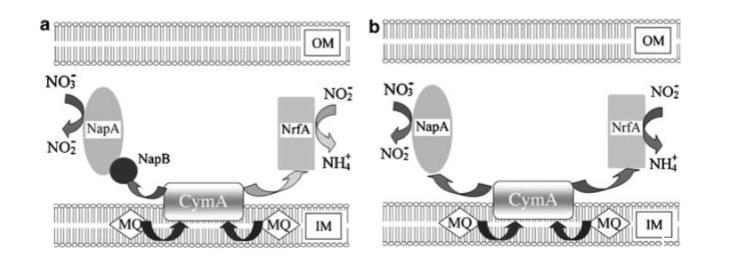
图5 希瓦氏菌中硝酸盐还原为铵的模型示意图。箭头表示电子传递路径。(a) 以硝酸盐或亚硝酸盐作为唯一电子受体的野生型菌株。深灰色箭头表示存在硝酸盐时的电子传递路径,浅灰色箭头表示硝酸盐完全消耗后或使用亚硝酸盐作为唯一电子受体时的电子传递路径。(b) 以硝酸盐作为唯一电子受体的AnapB突变株。深灰色箭头表示存在硝酸盐时的电子传递路径。
S.oneidensis细胞中亚硝酸盐的积累依赖于NapB。鉴于亚硝酸盐通常比硝酸盐对细胞的毒性大得多,S.oneidensis细胞从其基因组中的napB受益似乎出乎意料,正如竞争实验所显示的那样。然而,在硝酸盐量极其有限的真实环境中,这可能是完全合理的。通过将电子仅引导至NapA,NapB帮助S.oneidensis清除硝酸盐。同时,来自硝酸盐还原的亚硝酸盐几乎不可能达到足以对其生理产生负面影响的水平。
由于存在相应的末端酶和途径,微生物通常能够利用环境中的各种无机和有机物质。在大多数情况下,膜结合电子转运蛋白对其末端酶具有高度特异性,例如NapC对应NapAB、NirT对应NirS、NrfH对应NrfA等。尽管S.oneidensis以其异常多样化的呼吸代谢而闻名,但针对末端还原酶的特定膜结合电子转运蛋白的数量却少得惊人。为了解决这一难题,该细菌将CymA置于多个途径的分支点位置。与特定的NapC或NrfH不同,通用的CymA似乎进化出与几种末端还原酶相互作用的能力,证据是S.oneidensis可以同时利用富马酸盐和二甲亚砜(未发表的结果)。
在本研究中,我们清楚地表明NapB使CymA能够决定电子受体使用的层次结构。这可能是由于NapB的生化特性。在流感嗜血杆菌中,NapB两个血红素基团的中点还原电位出乎意料地低,导致从甲基萘醌池吸取电子具有巨大的热力学优势。在球形红细菌中,NapA与NapB的关联导致了一种结构排列,使得NapB的血红素I暴露给NapC以获取电子。血红素I具有较低的中点电位,因此是从NapC电子流动的更有利途径。在S.oneidensis的情况下,NapB将电子从CymA专一地转移至NapA,从而产生更有效的NapA。这种机制可能有助于该细菌在环境中清除低浓度的硝酸盐。考虑到其他几种途径也募集小的c型细胞色素从CymA获取电子,这种情况可能更为普遍。
多个途径共享CymA这一事实在所研究的Shewanella中很常见。有趣的是,在S.oneidensis、Shewanella sp.ANA-3和Shewanella putrefaciens CN-32中,共享CymA的途径数量分别为6、5和4,其中金属还原途径是共同的。这提供了一种可能性,即Shewanella可能最初对许多途径使用CymA,并随着时间的推移为其中一些途径获得专用的电子传递蛋白。如果这一点成立,S.oneidensis可能在途径进化方面代表一个初步阶段。
相关新闻推荐
1、微生物生长曲线分析仪:克氏锥虫在媒介肠道内的定植策略与生存智慧(一)
3、不同硝酸盐浓度下渤海和黄海聚球藻生长曲线、色素含量变化——材料与方法
