克氏锥虫在长红猎蝽消化道中载量的定量监测
我们评估了人工喂食含有10^7上鞭毛体(Dm28c)/毫升的补体灭活感染血液的昆虫的寄生虫载量,并在不同时间段后解剖。在感染后的最初24小时内,约92%的寄生虫被裂解,大多数存活的锥虫(1.9 x 10^5个细胞,占存活寄生虫的98.69%)存在于AM中,而常驻种群开始定植于PM(1.29%)。在感染后第4天,寄生虫种群开始定植于H,在第7天达到较高密度(约10^4寄生虫当量),而计数的总细胞中约6.8%±2.78(SE)(n=5)是循环后期寄生虫。在感染后第14天,循环后期寄生虫的比例增加,占总种群的25.2%±4.22(SE)(n=10)。
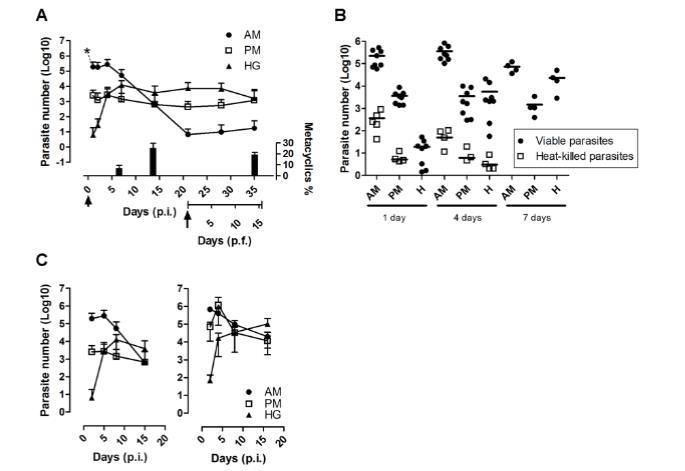
图2. 实时监测R. prolixus感染后克氏锥虫在不同肠道段的载量变化。(A)感染后(p.i.)及再次喂食后(p.f.)前中肠(AM)、后中肠(PM)和后肠(H)的寄生虫发育追踪。成虫饲喂浓度为10⁷细胞/毫升的血液。箭头与箭尖分别标示初始感染时间及21天p.i.时用不含寄生虫的血液进行再次饲喂的时间点。各时间点代表三次独立实验(n≥8)。后肠内容物中在7天p.i.、14天p.i.及14天p.f.时测得的后循环锥鞭毛体形态百分比(均值±标准误;n=10)已标注。(B)热灭活寄生虫DNA清除监测。分别使用活寄生虫或经65°C孵育2小时灭活的寄生虫进行感染。各时间点n≥4。(C)Dm28c株(左图)与CL Brener株(右图)克氏锥虫在R. prolixus肠道定殖情况对比。各时间点代表三次独立实验(n≥8)。在不同时间点解剖昆虫,分别从各肠道段提取总DNA,通过qPCR评估寄生虫数量。
值得注意的是,在重新进食两周后,循环后期寄生虫的比例保持稳定在19.1%±2.05(SE)(n=10)。同时,随着直肠寄生虫数量的增加,AM中的种群在感染后三周降至其较低水平(几十个寄生虫)。相比之下,PM和H中的锥虫种群在两周内保持恒定,分别为10^3至10^4寄生虫当量。为了表征清除动力学,在感染后三周喂食感染昆虫补体灭活血液,并在两周内通过qPCR评估每个肠道区段中的寄生虫数量。令人惊讶的是,尽管在此过程中动员了利尿和尿液流动,但三个种群维持了相似水平的寄生虫。这种相对恒定的寄生虫种群水平可能反映了媒介与寄生虫之间的紧密相互作用,并且是细胞复制产生的寄生虫数量与排泄物中释放的寄生虫数量之间平衡的结果。在AM和PM中,观察到寄生虫数量略有增加,表明存在作为储存库的寄生虫巢。
在感染后24小时观察到的大规模裂解事件引发了这样的可能性,即死寄生虫提供的DNA可能导致肠道中寄生虫载量的高估。为了评估残留在消化道中的死寄生虫释放的DNA模板量(最终可能被qPCR扩增),我们使用喂食含有10^6热灭活寄生虫/毫升血液的昆虫进行了对照实验。在AM和PM中,进食后24小时足以将寄生虫数量减少到比活寄生虫获得的数量低三个数量级,而在进食后四天,残留DNA的贡献降至喂食活寄生虫的昆虫低四个数量级。因此,裂解寄生虫DNA的初始贡献仅占总寄生虫数量的约0.1%。最后,昆虫肠道核酸酶对寄生虫DNA降解的动力学表明,需要7天才能完全去除所有残留DNA。这些数据表明,尽管在感染开始时大量寄生虫被裂解,但通过qPCR对寄生虫载量进行定量监测是活寄生虫的可靠测量方法。
接下来,我们比较了属于TcI(与森林循环相关)的Dm28c菌株(左图)与属于TcVI(与人类/家养循环相关)的另一种克氏锥虫品系CL Brener(右图)对昆虫的定植情况。在肠道不同区段中产生了CL Brener寄生虫载量的相似分布图,尽管观察到抗裂解性显著增加,特别是在PM中,在感染后第4天寄生虫相对数量达到10^6,即与Dm28c品系观察到的(5x10^3寄生虫)相比高出两个半数量级。两周后,所有肠道区段中的寄生虫载量变得稳定,并在H中达到最大值(约10^5个细胞)。总而言之,这些结果表明,qPCR方法可以以直接的方式用于研究不同寄生虫品系感染昆虫的定植动力学。
使用荧光和生物发光成像监测锥虫感染
我们通过BLI和荧光显微镜定性研究了消化道中活寄生虫的存在,以将这些数据与qPCR获得的数据进行比较。使用组成型表达荧光素酶的Dm28c品系(pBS:THT-Luc-T整合构建体),在血液餐后立即观察到充满寄生虫的AM,发出饱和光子(红色信号对应于辐射度~1.9x10^5 p/sec/cm2/sr),光子发射存在一些变异性,反映了昆虫摄入血液量的可变性(平均242.9±27.9μl,n=10±SD)。6小时后,AM中的光发射显著减少,大部分高强度信号向昆虫腹部后部移动。24小时后,信号完全从AM中消失,与最大辐射光子发射的大幅下降相关,并且一些红点分布在昆虫腹部的后端。从感染后第3天到第7天,我们观察到发光信号减少,并且在某些情况下,AM重新定植,这可以解释为分裂的常驻上鞭毛体和/或从PM移回的寄生虫。尽管发光强度的降低与寄生虫数量的减少成正比,正如最大辐射光子发射与体外细胞数量呈正相关所证实的那样,但使用BLI对完整昆虫体内寄生虫进行体内定量的方法显然受到该技术固有的高检测阈值限制的限制。
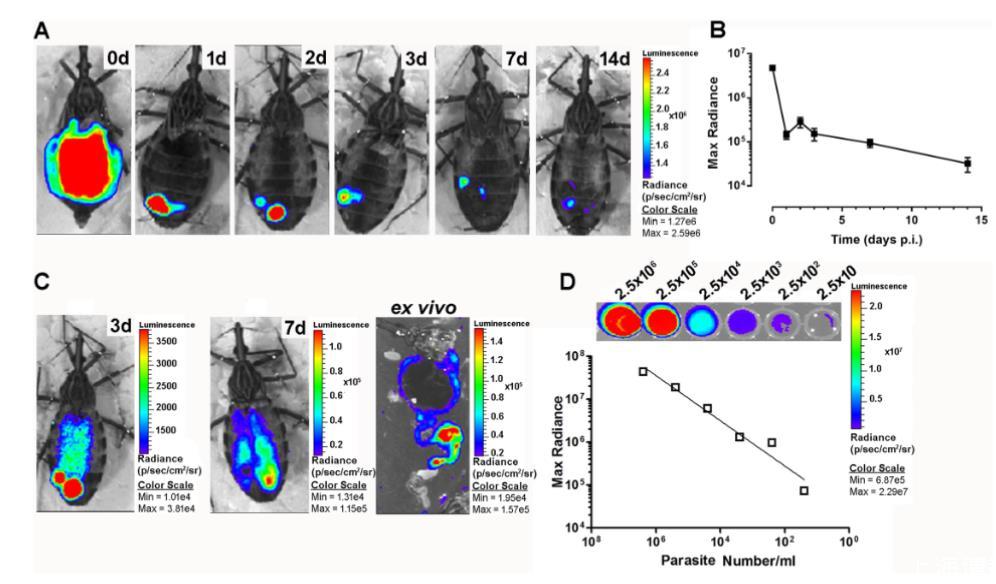
图3. 实时体内生物发光成像(BLI)技术观察R.prolixus体内克氏锥虫感染。(A) 使用持续表达荧光素酶的克氏锥虫Dm28c上鞭毛体感染昆虫,通过BLI技术对感染进程进行为期两周的时序监测。(B) 对A图所示时间点受感染昆虫发射的发光信号进行量化分析。(C) 感染后第3天和第7天的体内发光评估,以及第7天的离体发光评估。(D) 各检测孔测量的生物发光强度与寄生虫数量的相关性。图像代表三次独立实验中每个时间点至少24只昆虫的分析结果,所有时间点的昆虫图像均用于计算发光信号的平均强度。
两周后,信号减少到PM的一些点状部分。重新进食后一到两周,发光信号完全从昆虫中肠消失,仅限于直肠。总而言之,BLI数据证实了qPCR结果,显示在感染后最初24小时内发生了大规模裂解,并证明这一过程开始得非常早,大约在血液餐后6小时。体外解剖证实了寄生虫向PM的迁移以及AM中信号的完全缺失。为了分析细胞裂解事件是否是由于锥蝽的细菌内共生体(例如放线菌罗氏红球菌,这是我们昆虫群体中发现的唯一可培养肠道细菌)引起的,我们用含有表达荧光素酶的克氏锥虫或表达荧光素酶的克氏锥虫加不同浓度的罗氏红球菌(比饥饿的长红猎蝽AM中的浓度高2到10倍)的血液感染昆虫。尽管细菌载量显著增加,但在感染后24小时,两组昆虫之间的发光信号强度没有显著差异。我们还检查了添加到血液中作为抗凝剂的肝素(2.5 U/ml)对罗氏红球菌体外生长没有影响。
相关新闻推荐
1、4抗生素对莱茵衣藻生长、光化学活性及其伴生细菌的抑制作用(二)
