从受感染昆虫消化道样品中提取DNA
测试了几种DNA提取方法,以从受感染昆虫的消化道样品中纯化DNA(酚-氯仿提取、QIAamp DNA mini kit(Qiagen)和十六烷基三甲基溴化铵(CTAB))。用于从血液样品和动物组织中纯化DNA的经典酚-氯仿方法不适用于从昆虫肠道中纯化DNA,因为其血色素含量高,在进食后第3天至第21天收获的PM和H样品中不可避免地发现血色素。如前所述,即使在血液样品处理过程中,与DNA共纯化的PCR抑制剂的存在也会影响qPCR反应的效率,并导致寄生虫载量的低估。尝试了另一种基于硅-DNA结合技术的方法(QIAamp DNA mini kit,QIAGEN)。
结果显示,由于血色素的存在,DNA回收效率严重降低,产生褐色DNA沉淀,假阴性PCR结果证实了这一点。只有后一种使用CTAB的技术提供了可重复的结果,这可能是由于DNA选择性沉淀以及血红素/血色素和多糖的消除。在用组成型表达GFP的寄生虫感染后,在指定的感染后时间点从冷麻醉的昆虫中提取AM、PM和H。每个肠道区段分别在1 ml溶液A(1.5%CTAB;2 M NaCl;10 mM EDTA;100 mM乙酸钠,pH 4.6)中匀浆。匀浆后,将100μl等分试样转移到含有900μl溶液B(溶液A含有10μg鲑鱼精子DNA作为DNA载体,10 ng质粒pLew82(ble)和125μg RNAse A/每900μl等分试样)的2 ml微量离心管中,涡旋2分钟。然后将样品在65°C加热30分钟以激活RNAse A活性。加入500μl氯仿后,将样品在65°C加热2小时。在此步骤之后,将样品在室温下孵育10分钟,并在25°C下以9,000 x g离心。将600μl水相等分试样转移到新管中后,向样品中加入300μl氯仿,涡旋2分钟。然后将样品在室温下孵育10分钟,并在25°C下以20,000 x g离心10分钟。将每个样品水相的400μl等分试样在加入1μl 20 mg/ml糖原溶液(Sigma-Aldrich)(或鲑鱼精子DNA(ssDNA),提供可比较的结果)、40μl 3 M乙酸钠(pH 5.2)和1 ml冰乙醇后,在-20°C沉淀1小时。然后在4°C下以20,000 x g离心样品10分钟。将DNA沉淀用冷70%乙醇洗涤两次,在室温下干燥,并重悬于50μl无核酸酶水中。
寄生虫标准校准曲线
克氏锥虫DNA标准品分别从感染后第7天无寄生虫的整个肠道匀浆物或兔血中获得,将10^7寄生虫用无核酸酶水进行10倍系列稀释,并含有10 ug/ml鲑鱼精子DNA(ssDNA),以覆盖Dm28c和CL Brener品系分别为10^6至0.001或2.5 x 10^5至2.5寄生虫当量的范围,每5μl样品加入反应混合物中。
质粒标准校准曲线
内标(pLew82)的标准校准曲线使用与寄生虫校准曲线相同的重构样品进行;将昆虫肠道匀浆物或兔血样品掺入10 ng质粒,并用含有10μg/ml鲑鱼精子DNA(ssDNA)的无核酸酶水进行10倍系列稀释,以覆盖10至0.01 ng质粒的范围。
异源内标
所有样品在提取过程中均存在10 ng pLew82质粒作为异源内标。内标的标准校准曲线用于确定提取后的DNA回收百分比。
实时PCR和寄生虫定量
使用StepOnePlus实时PCR系统(Applied Biosystems)和Power SYBR Green PCR预混液(Applied Biosystems)进行qPCR,最终体积为15μl。PCR反应由5μl DNA样品和500 nM克氏锥虫重复DNA特异性引物组成,该引物从串联重复卫星DNA扩增182 bp的扩增子。特异性克氏锥虫DNA寡核苷酸为TcFw(5'-GCTCTTGCCCACAMGGGTGC-3'),其中M=A或C,和TcRv(5'-CCAAGCAGCGGATAGTTCAGG-3')。同时,进行含有5μl DNA样品和500 nM设计用于PCR扩增质粒pLew82中Sh ble基因148 bp片段的寡核苷酸的反应,使用以下引物组:BleFw(5'-CAAGTTGACCAGTGCCGTTC-3')和BleRv(5'-GCTGATGAACACGGGTCACG-3')作为上样对照。两种引物对使用的qPCR条件如下:95°C 10分钟,然后进行40个循环的95°C 15秒和60°C 15秒(数据收集)。扩增步骤后进行熔解曲线分析,以确保扩增出单一产物。使用StepOne软件v2.3分析数据。两种引物对的阴性对照均为不含DNA的反应。对于每个引物组,使用以下公式确定扩增效率:效率(E)=-1+10^(-1/斜率)。qPCR实验使用的方案遵循定量实时PCR实验发表所需最低信息(MIQE)指南。
每个肠道区段寄生虫载量的归一化和定量
从DNA样品中定量寄生虫当量时,考虑了标准克氏锥虫DNA的扩增曲线和加入孔中的DNA百分比。根据异源内标扩增曲线对结果进行归一化。
结果
CTAB纯化DNA对不同系统发育克氏锥虫品系的qPCR分析灵敏度
在测试的几种从昆虫肠道纯化DNA的提取方法(酚-氯仿、QIAamp DNA mini kit(Qiagen)和CTAB)中,只有后者提供了可重复的结果且无PCR反应抑制。因此,选择该方法纯化DNA。类似地,特别注意添加到血液中作为抗凝剂的肝素浓度,因为其众所周知的PCR反应抑制作用。由于柠檬酸盐或EDTA对昆虫的毒性,尤其是在进食后长时间内变得特别明显,因此放弃了使用柠檬酸盐或EDTA作为抗凝剂。
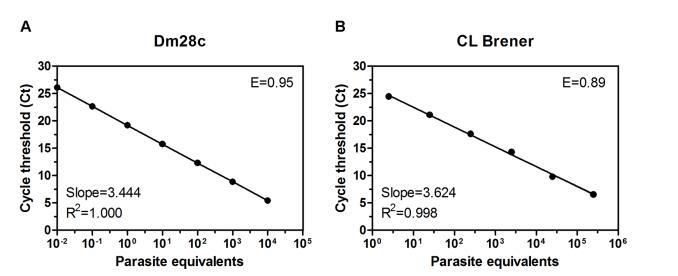
正如预期的那样,即使在存在ssDNA作为DNA载体的条件下,不同肠道样品的DNA回收率也高度可变,需要异源内标来对每个样品提取的DNA回收率进行归一化。我们首先评估了使用连续稀释的质粒(含有ble抗性基因)掺入肝素化兔血中,与纯化的克氏锥虫DNA靶向重复卫星序列相比,内标PCR扩增的效率。获得了两种扩增子的高度相似的扩增效率百分比(卫星DNA的E=0.95 vs.ble的E=0.96),从而验证了qPCR中使用内标的有效性。因此,通过连续稀释来自Dm28c(TcI)和CL Brener(TcVI)参考库的纯化DNA,在通过掺入血液裂解物的质粒DNA归一化后,确定了基于克氏锥虫卫星DNA的qPCR的灵敏度。qPCR对CL Brener和Dm28c品系的检测限分别为1和0.01寄生虫当量(循环阈值(Ct)数约为25)。低于0.01的寄生虫浓度仍可检测到,但Ct值较高(约30),接近检测限背景。CL Brener和Dm28c品系的动态范围、扩增效率和R2值(决定系数)分别为0.01-10^4和1-10^5寄生虫当量、89%和95%以及0.998和1.000。为了确定从整个肠道匀浆物中分离出的某些PCR抑制剂痕迹是否能够影响PCR效率和灵敏度,我们通过用组织特异性昆虫匀浆物(进食后一周解剖的整个消化道AM、PM和H)替换血液DNA,对Dm28c进行了qPCR扩增。动态范围、扩增效率和R2值分别为0.001-10^4寄生虫当量、92%和1,与血液DNA提取物提供的结果相似。因此,无论DNA来源如何,都生成了具有相似高灵敏度的标准曲线,验证了qPCR检测的稳健性。
这些数据表明,使用Moser改良引物(设计用于扩增来自血液或昆虫肠道匀浆物纯化的不同克氏锥虫品系的卫星DNA)与内标(ble)相结合,成功地在两个参考库中产生了精确的标准寄生虫校准曲线。因此,该方法提供了一种优化的可靠qPCR检测方法,适用于量化昆虫肠道中的寄生虫DNA。
相关新闻推荐
1、生长曲线分析仪揭示Afg3在细胞质mRNA翻译和衰老过程中的新角色
2、水稻黄单胞菌噬菌体最佳MOI (A)、一步生长曲线、耐受性测定及基因组分析(二)
3、转录组技术分析产紫篮状菌抑制尖镰孢菌生长的作用机制——讨论与结论
