表达Rip1(P166S)突变蛋白的酵母表现出呼吸缺陷,该缺陷被系链区域的突变所挽救
为了确定isp-1(qm150)突变和抑制子的结构-功能关系在门类间是否保守,我们将类似的突变引入酿酒酵母Rieske铁硫蛋白Rip1中。酵母rip1△突变体能够进行发酵生长(图5A),但呼吸缺陷(25),这表现在无法在以非发酵性甘油作为唯一碳源的培养基上生长(图5B)。为了评估表达带有和不带有抑制子的Rip1的影响,将含有突变RIP1的质粒引入缺乏RIP1基因(rip1△)的单倍体酵母中。
重新引入RIP1基因的野生型拷贝挽救了rip1△呼吸缺陷,正如预期的那样。表达含有P166S突变的Rip1的酵母(类似于线虫isp-1(qm150)突变)在呼吸条件下表现出生长缓慢,表明这种脯氨酸到丝氨酸的突变在酵母和线虫中都强烈削弱了线粒体呼吸功能。D87N突变部分抑制了由P166S突变引起的呼吸缺陷,而A90T突变更强烈地挽救了这种缺陷(图5 A和B)。还在液体培养条件下测定了生长,其中酵母在葡萄糖耗尽期间(称为双峰转换,图5C中约12小时的生长)从发酵代谢转变为呼吸代谢。表达P166S突变的酵母在双峰转换期间生长不良,而抑制突变改善了这种缺陷。这些发现反映了我们在秀丽隐杆线虫中的结果,证明了iso-1(qm150)突变和我们分离的抑制子的效应是保守的(图5D)。
讨论
在这项研究中,我们鉴定了几种isp-1(qm150)的基因内抑制子,它们不仅增强了isp-1(qm150)动物的缓慢发育速率,而且还抑制了其他表型,包括咽部泵送速率、繁殖力大小、身体运动、线粒体未折叠蛋白反应、CO2产生、线粒体氧化磷酸化(O2消耗)、寿命延长以及先前未报道的对高氧(100%O2)的敏感性。几乎所有isp-1(qm150)的基因内抑制子突变都发生在ISP蛋白的一个小的、高度保守的系链区域,该区域由六个氨基酸DQRALA组成(D_A_A在α-变形菌、酵母、线虫、鸡和人类中保守)。复合物III的晶体结构揭示,含有2Fe-2S铁硫簇的ISP外在移动结构域可以存在于电子供体位点(Qo位点,泛氢醌氧化的催化位点)附近,或者存在于电子受体位点(cyt c1位置)附近。
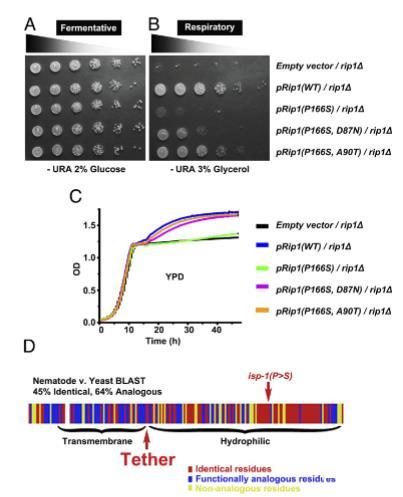
图5. 拴系突变挽救酿酒酵母Rip1(P166S)的呼吸缺陷。将缺失整个RIP1基因开放阅读框(rip1△)的酵母细胞分别转化含空载体质粒、表达野生型Rip1(WT)、Rip1(P166S)、D87N(Sea1)修饰的Rip1(P166S)或A90T(Sea4)修饰的Rip1(P166S)的质粒。表达Rip1(P166S)的酵母呼吸生长能力显著受损,而拴系区域内的二次突变D87N或A90T可挽救此缺陷。(A和B)在含2%(质量/体积)葡萄糖(发酵条件;A)或3%(质量/体积)甘油(呼吸条件;B)的固体合成培养基上评估生长情况。(C)通过Bioscreen液体培养实验在含2%(质量/体积)葡萄糖的富培养基中生成生长曲线。(D)Rip1与isp-1保守性对比。
由于这些电子供体和受体位点之间的间隙太大,无法允许观察到的电子转移速率,因此推测了ISP头部单元的移动。多项研究支持这样的观点,即系链区域是一个柔性元件,对ISP头部区域的移动很重要,移动的ISP头部结构域有两个或三个主要位置,要么在电子供体处,要么在受体位点处,或者处于中间状态。因为氧化的ISP(ISPox)是决定复合物流量的限速分支反应的底物,isp-1(qm150)等位基因的多效性表型及其抑制可能反映了这一作用。
先前鉴定isp-1(qm150)发育迟缓表型抑制子的努力,在线粒体编码的细胞色素b基因ctb-1中发现了一个突变(A170V)(6)。已鉴定的ctb-1抑制子qm189与我们系链区域抑制子之间的一个表型差异是,据报道ctb-1(qm189)没有改变isp-1(qm150)的寿命延长。这种差异的原因尚不清楚,但可能源于这些抑制子在不同亚基上的位置,以及它们对复合物III及其在呼吸体中的伙伴复合物的不同影响。Suthammarak等人报道isp-1(qm150)不仅强烈降低了复合物III的活性,还降低了在溶解线粒体中测量的复合物I活性。
抑制子ctb-1(qm189)没有挽救复合物III活性,但令人惊讶地改善了复合物I活性,这表明通过超复合物内的变构效应存在一种挽救机制。相比之下,我们的系链区域抑制子qm150sea4恢复了结构完整线粒体的氧化磷酸化,无论电子是通过复合物I还是II进入ETC,表明复合物III活性得到挽救。此外,qm150sea4线粒体中正常的复合物I依赖性呼吸表明,如果qm150导致额外的复合物I缺陷,这也得到了挽救。(我们的极谱法无法验证qm150中是否确实存在复合物III和I的联合缺陷。)
值得注意的是,酿酒酵母没有真正的复合物I,而是依赖三种单一酶NADH脱氢酶(Nde1、Nde2和Ndi1)来执行这一活性。因为酵母D87N(sea1)和A90T(sea4)突变足以挽救由Rip1中P166S突变引起的呼吸缺陷,这进一步表明这些系链区域突变足以恢复复合物III活性。通过与酵母结构的同源性,ctb-1 A170残基位于一个钳位中,该钳位由cyt b(二聚体的两个亚基)和cyt c1的跨膜区段贡献,在ISP从锚定螺旋的C末端出现时将其固定。在酵母中,等效残基P174与ISP系链跨膜区-TADV-相邻。因为钳位限制了系链,变化可能会改变ISP头部移动的控制,因此这可以被视为支持一个模型,在该模型中,isp-1(qm150)头部区域的缓慢构象变化可能解释了ETC功能降低和观察到的表型(发育缓慢、排便缓慢、运动缓慢等)。
在酵母中,我们的数据说明脯氨酸166突变为丝氨酸导致呼吸功能急剧减弱,并且系链区域内的次级基因内突变(D87N和A90T)可以挽救这种缺陷。另一个突变G175S,位于与P166相同的介入区域内,也被报道会降低酵母的呼吸能力,尽管是以温度敏感的方式。由于P166的位置和脯氨酸提供的结构刚性,该残基可能对维持环的三级结构很重要。值得注意的是,先前发现该脯氨酸残基突变为亮氨酸会降低铁硫簇的中点氧化还原电位,而系链区域的突变已被证明会提高铁硫簇的中点电位。然而,尽管这些相反的效应与长寿和抑制子现象相关,但对氧化还原电位变化分子基础的研究,特别是来自系链突变的研究,表明它们不涉及对簇的直接影响,而是由结构-功能相互作用介导。
来自更广泛文献的物理化学参数促使我们研究野生型中ISP头部结构域在Qo位点相对较弱结合之间的相互作用,以及与系链区域构象变化相关的力,这支持了一种替代的弹簧加载机制。简而言之,我们建议当ISP复合物与Qo位点占据物形成时,两组相反的力量在起作用,一组(与复合物形成相关的力)拉动簇结构域,另一组(“弹簧”)拉动外在结构域另一端的系链。复合物形成与系链跨膜区弹簧的伸展和松弛构象变化相一致,所有力都由氢键和范德华相互作用介导,这些相互作用在这些区域发生突变时被差异性地修饰,从而产生观察到的效应。
相关新闻推荐
1、高产蛋白酶乳酸杆菌高效筛选方法、生长曲线测定及耐受能力分析(二)
2、实验证明:非脱羧勒克菌wt16可抑制黄曲霉生长性及产毒(二)
3、粪肠球菌SX106生长曲线、产酸曲线、耐酸/胆盐及抗氧化能力测定(二)
