硝化应激
Fzf1是唯一与硝化应激相关的遗传命中点。然而,ResponseNet将其连接到四个上调转录本,包括编码Pdi1的转录本,一种蛋白质二硫键异构酶(PDI)。值得注意的是,人类PDI的上调保护神经元细胞免受与ER应激和蛋白质错误折叠相关的神经毒性(两者在酵母和神经元中都与α-syn表达相关),且PDI是在PD中被S-亚硝基化的少数特异性蛋白质之一,激活保护性通路,besides作为疾病标志的generalized硝化损伤。我们发现α-syn表达增加导致蛋白质的特异性和generalized S-亚硝基化增加。这非常令人惊讶,因为酵母基因组不编码规范型一氧化氮合酶,且直到最近,酵母被认为不产生一氧化氮。我们的结果表明特定蛋白质的亚硝基化和generalized亚硝化是对α-syn创建的细胞扰动的高度保守和deeply rooted响应。
热休克
热休克响应的诱导直接或通过Hsp90的化学抑制抑制α-syn毒性在许多模型系统中包括酵母、果蝇、小鼠和人类细胞。然而,热休克相关基因在遗传抑制因子列表中conspicuously缺失。尽管如此,ResponseNet预测了两个高度保守的热休克调控因子的参与,伴侣蛋白Hsp90(同工型Hsp82)和热休克转录因子Hsf1。Hsf1出现在毒性抑制因子Gip2下游,Gip2是Glc7磷酸酶的推定调控亚基,与Gac1相互作用。Gac1是已知激活Hsf1的Glc7复合物的调控亚基。这些连接表明Gip2过表达可能诱导热休克响应。确实,我们发现过表达Gip2的菌株显示热休克蛋白浓度升高。ResponseNet因此为Gip2过表达实现的α-syn毒性抑制提供了机制解释,并识别了高度保守热休克响应的新调控因子。
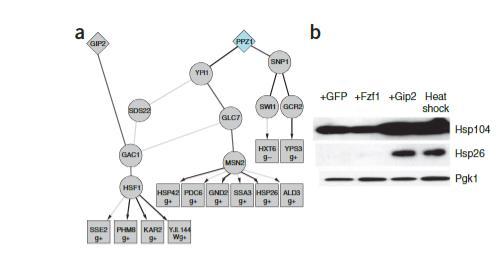
图4 Gip2过表达导致Hsf1靶基因诱导表达。(a)预测子网络通过1型蛋白磷酸酶复合物组分(Gac1,Glc7,Ypi1,Sds22)将毒性抑制因子Gip2与毒性增强因子Ppz1连接到Hsf1和Msn2。图示呈现方式与图2类似。(b)用过表达GFP、Fzf1或Gip2的载体细胞进行免疫印迹,使用抗Hsp104和Hsp26抗体。Gip2过表达足以激活Hsf1并诱导其靶标Hsp104和Hsp26的蛋白水平升高,与经历热激处理的载体细胞相似。相比之下,过表达另一种遗传抑制因子Fzf1则不会激活Hsf1。使用抗Pgk1抗体进行免疫印迹作为上样对照。
甲羟戊酸-麦角固醇生物合成通路
该通路是他汀类药物(降胆固醇药物)的靶标,合成固醇以及其他与α-syn毒性相关的产品,如囊泡运输蛋白质所需的法尼基基团和线粒体呼吸所需的辅酶Q。ResponseNet高度排名Hrd1,它调控他汀类药物的蛋白质靶标,和预测的中间体Hap1,该通路的推定转录调控因子。此外,α-syn mRNA谱与用洛伐他汀处理的酵母的谱modestly相关,且几个遗传命中点也可以与通路产品相关联(酶Bet4和Cax4,法尼基化蛋白质Ypt1和Ykt6,以及推定固醇载体Sut2、Osh2和Osh3)。我们因此测试了洛伐他汀(选择性抑制酵母和哺乳动物细胞中高度保守的HMG-CoA还原酶蛋白质)对α-syn毒性的影响。向培养基添加5μM洛伐他汀导致过表达α-syn的菌株生长进一步减少,但不减少野生型对照或表达另一种毒性蛋白质(亨廷顿蛋白外显子I的谷氨酰胺扩展变体)的细胞的生长。我们进一步测试了辅酶Q,该通路的下游输出,推理通过α-syn作用其下调可能增加细胞脆弱性。确实,向培养基添加辅酶Q-2提供了对α-syn毒性的轻微抑制。辅酶Q是一种抗氧化剂,但这不是非特异性抗氧化响应,因为抗氧化剂N-乙酰半胱氨酸没有效果。
雷帕霉素靶标(TOR)通路
ResponseNet识别TOR通路蛋白质Tor1、Tor2及其靶转录因子作为遗传抑制因子Lst8(TOR通路的正调控因子)和几个涉及孢子壁形成(酵母中vectorially定向分泌过程)和液泡蛋白质降解的上调基因之间的中间体。我们发现向培养基添加TOR抑制剂雷帕霉素显著增强α-syn的毒性。确实,低剂量的α-syn(否则无害)变得有毒。建立这种效应对α-syn的特异性,雷帕霉素不减少表达亨廷顿蛋白外显子I谷氨酰胺扩展变体的细胞的生长。尽管先前研究suggested雷帕霉素治疗在PD模型中的益处,这些结果呼吁进一步调查,并表明对雷帕霉素响应的复杂性potentially due to TOR激活影响的vast范围过程。
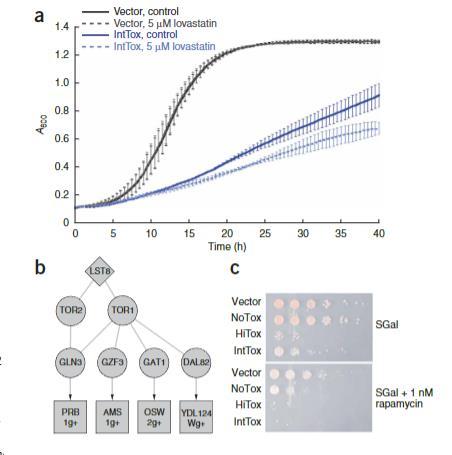
图5 小分子洛伐他汀与雷帕霉素对α-突触核蛋白毒性的影响。(a)洛伐他汀抑制表达中等水平α-突触核蛋白酵母菌株的生长。在含半乳糖培养基中(添加/不添加5μM洛伐他汀)测定对照菌株(空载载体)和表达多拷贝α-突触核蛋白的中等毒性菌株(IntTox)的生长曲线。每条生长曲线反映三次独立实验的平均值,每次实验数据以柱状图表示。(b)预测包含TOR通路组件的子网络中含有预测蛋白Tor1与Tor2。图示呈现方式同图2c。(c)雷帕霉素对不同酵母菌株生长的影响。上图显示对照菌株(空载载体)、表达单拷贝α-突触核蛋白的无毒株(NoTox)、表达多拷贝α-突触核蛋白的高毒株(HiTox)和中等毒性株(IntTox)在诱导α-突触核蛋白表达的半乳糖培养基(SGal)中的生长情况;下图显示相同菌株在添加1 nM雷帕霉素培养基中的生长情况,可见雷帕霉素抑制所有表达α-突触核蛋白的菌株生长(通过液滴菌落数差异观察),但不影响对照菌株。各列对应系列稀释梯度。
讨论
我们提供了一个新颖框架,其中遗传、物理和转录数据在细胞对生物扰动响应的背景下自然互补。尽管这些数据的互补性已被注意到,但刺激特异性遗传修饰因子和转录响应之间关系的系统性分析缺乏。通过检查超过150种distinct刺激,我们发现差异表达基因和遗传命中点consistently disparate;遗传命中点偏向调控蛋白质,而差异表达基因偏向代谢过程。确实,每种检测都有固有“盲点”。许多酵母调控蛋白质不被转录检测检测到,因为它们主要受转录后调控,具有低转录物浓度,或其差异表达是瞬态的,使得变化难以测量。相反,差异转录的基因通常涉及代谢过程或冗余功能,这些往往对单突变稳健。
遗传命中点和差异表达基因之间的不一致对寻找治疗策略有影响。在酵母中,灭活差异表达基因不影响细胞存活的可能性不高于靶向随机选择的基因。使用像ResponseNet这样的技术桥接这些数据之间的差距可以potentially揭示未在高通量检测本身中发现的干预点,这些点可能被药物靶向。
我们的计算方法基于流算法连接遗传命中点和差异表达基因。与将靶基因与其因果转录变化连接的研究不同,基于流的方法允许对多个靶基因进行全局、高效和同时的解决方案,而不对输出结构施加先验边界。确实,预测的输出网络具有丰富的结构,一半路径具有三条或更多边。ResponseNet分析包含数万节点和边的相互作用组数据的能力使其非常适合分析来自其他物种或其他技术的积累数据。
我们将我们的方法应用于α-syn病理生物学的酵母模型。如其他研究have shown,α-syn过表达改变α-syn毒性。这些包括涉及囊泡运输(如先前报道)、蛋白质降解、细胞周期调控、硝化应激、相容性溶质生物合成和锰转运的基因。该筛选建立了α-syn与大量先前与神经病理学相关的细胞和环境因素之间的接口,并在某些情况下specifically与帕金森综合征相关,但未specifically与α-syn linked。我们识别的许多基因在人类中高度保守,它们可能发挥类似effects。
应用ResponseNet到α-syn模型成功为我们酵母筛选中识别的许多遗传命中点提供了功能背景,并指出几种细胞通路的参与。其中,甲羟戊酸-麦角固醇通路特别令人感兴趣,因为其扰动可能potentially改变各种下游通路,包括与酵母模型中观察到的囊泡运输缺陷和线粒体功能障碍密切相关的蛋白质法尼基化和辅酶Q生物合成。确实,固醇生物合成与PD病因学之间的联系最近出现。PD个体的低密度脂蛋白(LDL)胆固醇浓度显著低于其配偶,且低LDL浓度在一组日裔男性中先于PD出现。我们的工作为阐明这种连接提供了分子框架。
通过整合高通量遗传、转录和物理数据获得的全局图景展示了整合方法阐明未充分探索细胞过程的威力。随着高通量检测在研究复杂疾病和发育过程中变得常规,基于其底层特征decipher这些数据的方法至关重要。
相关新闻推荐
1、人胚肺二倍体细胞不同代次Walvax-2细胞周期及衰老程度评定
3、不同硝酸盐浓度下渤海和黄海聚球藻生长曲线、色素含量变化——结果与讨论、结论
