SMu0629是AtlA正常生产所必需的。 使用全细胞裂解物的SDS-PAGE和Western印迹分析显示,SMu0629基因的破坏显著影响了AtlA的生产和加工。特别是,与UA159相比,629NP和629P突变体中AtlA加工形式的数量显著减少,因此atlA转录减少可能不是观察结果的原因。由于AtlA被认为是变形链球菌的主要自溶素,我们检查了突变菌株在44°C的自溶活性。如图3D所示,629NP和629P突变体都显示出较低的自溶速率,类似于atlA缺陷突变体。因此,很可能缺乏SMu0629的菌株中AtlA成熟效率降低导致自溶减少,除非SMu0629可以直接参与细胞自溶或影响其他肽聚糖水解酶的活性。
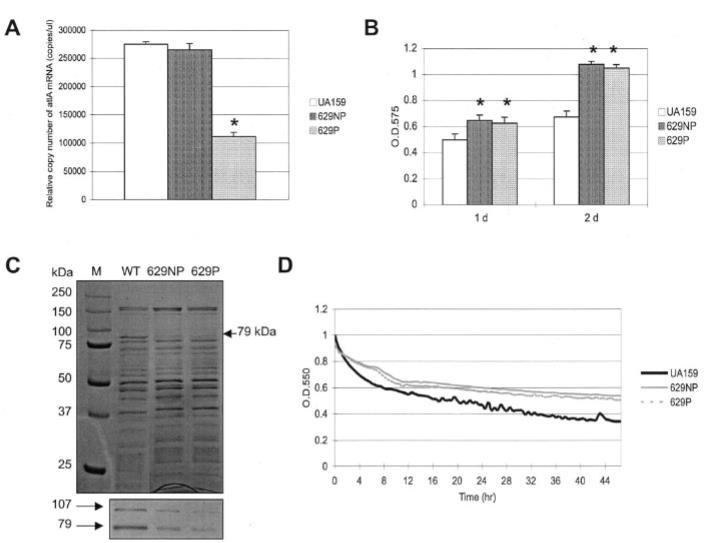
图3. SMu0629突变体(非极性突变629NP和极性突变629P)的表型特征分析。(A)通过实时荧光定量PCR监测atlA基因表达。使用UA159(野生型)、629NP和629P菌株的总RNA,采用630反向引物进行逆转录反应测定atlA mRNA。(B)生物膜形成能力。菌株在补充葡萄糖的BM培养基中培养1或2天。数据代表至少进行三次重复的两次独立实验。误差线表示标准差。*表示P<0.01(1天)或P<0.001(2天)(学生t检验)。(C)变异链球菌野生型(WT)和两种SMu0629突变体(629NP和629P)的珠磨-SDS煮沸提取物SDS-PAGE分析。经SDS-PAGE后,蛋白质分别用考马斯亮蓝染色(上图)或转印至硝酸纤维素膜并使用1:350稀释度的抗630D1多克隆抗血清进行Western blotting(下图)。M为分子量标准。(D)自溶实验。菌株自溶活性在Bioscreen C系统中监测,该系统设置为每30分钟检测前震荡15秒。细胞悬浮液在AtlA自溶最适温度(44°C)下培养。黑色线:UA159;灰色线:629NP;灰色虚线:629P。
我们先前证明,AtlA缺陷菌株的缺陷可以通过向atlA突变体培养物中添加少至2 ng ml-1的纯化AtlA蛋白来纠正至野生型水平,并且在这些条件下全长蛋白可以加工为79 kDa形式。当将纯化的His标签AtlA蛋白以2.0 ng ml-1的浓度添加到630P和SAB95培养物时,产生正常长度链的能力得到恢复,并且缺乏SMu0629的菌株仍然可以将107 kDa形式转化为AtlA的成熟形式,表明SMu0629可能在分泌或定位过程中对AtlA生物发生重要,但不直接参与AtlA在细胞表面的加工。此外,尽管SMu0629是AtlA高效表达和加工所必需的,但在测试条件下可能有足够水平的正确加工AtlA可用以表达评估的表型。
SMu0629基因突变体对氧气更敏感。 SMu0629功能的一个假设是,凭借其与硫醇-二硫键氧化还原酶的序列相似性,它参与变形链球菌对氧化环境的适应,可能通过感知氧化还原状态和调节AtlA的成熟。由于该蛋白家族的某些成员保护细胞对抗氧化应激或参与细胞氧化还原活性,测试了SMu0629基因突变体对氧化应激的反应。用0.2% H2O2处理的H2O2杀伤实验未显示指数生长期中期629NP、629P或亲本菌株存活的显著差异。
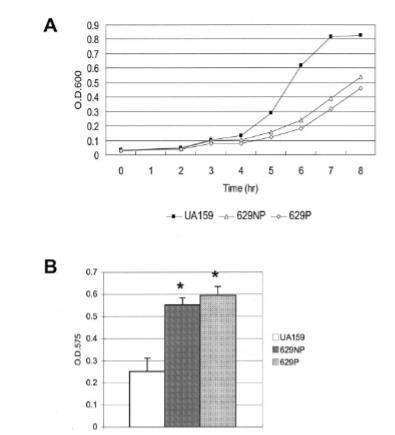
图4. 变形链球菌菌株(UA159、629NP和629P)需氧生长的影响。需氧培养采用旋转摇床(150 rpm)进行。(A)生长曲线。菌株在37°C的BHI培养基中生长,所示数据来自三次独立实验中具有代表性的一次实验,且三次实验结果一致。(B)生物膜形成。菌株在补充有终浓度为20 mM葡萄糖的BM培养基中,通过摇床(150 rpm)进行需氧培养。更多细节见正文。数据代表至少两次独立实验(每次实验重复三次或以上)的结果。误差棒表示标准差。*,P < 0.001(学生t检验)。
当在通气条件下生长时,缺乏SMu0629的菌株显示出显著较低的生长速率,并且比野生型形成更多聚集体。使用Bioscreen系统获得的结果通过试管中的生长确认,以确保较低的生长速率不是细胞聚集的假象。此外,SMu0629基因的破坏使生物体在氧气存在下比野生型菌株形成更多生物膜,类似于atlA突变菌株。总之,我们的结果表明,当细胞暴露于氧气时,SMu0629基因突变体和野生型菌株之间存在显著的表型差异。
VicK传感器激酶影响SMu0629基因表达和AtlA成熟。 VicRK TCS被研究作为atlA操纵子或AtlA活性的可能调节系统。变形链球菌的Vic系统,对某些相关物种指定为CovRS,最近被显示调节葡糖基转移酶基因(gtfBCD)、果糖基转移酶基因(ftf)和gbpB的表达,后者编码葡聚糖结合蛋白B。这些基因产物密切参与外多糖生产,而Gtfs和Gbps尤其对蔗糖依赖性粘附和生物膜形成至关重要。Vic的缺失影响变形链球菌生长、蔗糖依赖性粘附、生物膜形成和遗传能力发展。在变形链球菌UA159的vicK基因中产生缺失突变。vicRKX基因座中的所有三个基因被显示在一个操纵子中,因此vicK通过非极性插入(vicK-NP)破坏。由于我们无法分离vicR无效突变体,vicK-NP在本研究中用作Vic缺陷菌株。该突变菌株具有改变的生长速率,并在静态生长期间在试管底部聚集。突变体形成生物膜的能力在BM-葡萄糖和BM-蔗糖培养基中显著降低,证实了先前研究中的观察。
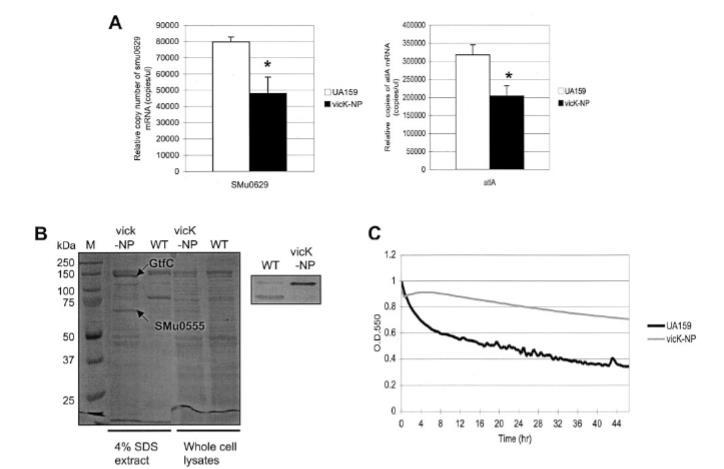
图5. vicK突变体(vicK-NP)的表型特征分析。(A)通过实时荧光定量PCR检测SMu0629和atlA基因的表达。使用UA159(野生型)和vicK-NP菌株的总RNA,分别采用629-反义引物和630-反义引物进行逆转录。数据为三次独立实验的平均值±标准差(误差线)。*表示P<0.05(学生t检验)。(B)野生型(WT)与vicK-NP变异链球菌菌株两种不同细胞提取物的SDS-PAGE分析。经过SDS-PAGE后,蛋白质采用考马斯亮蓝染色(左图)或转印至硝酸纤维素膜进行Western blotting(全细胞裂解液)分析,使用1:350稀释度的抗630D1多克隆抗血清(右图)。M泳道为分子量标准。从染色凝胶中切取目标条带进行质谱分析。(C)自溶实验。在Bioscreen C系统中监测菌株的自溶活性,该系统设置为每30分钟检测前震荡15秒。细胞悬浮液在AtlA自溶活性的最适温度(44°C)下培养。粗线代表UA159;细灰线代表vicK-NP。
为了研究VicK对atlA操纵子的调节功能,我们首先比较了vicK突变体和野生型菌株中SMu0629基因和atlA的表达(图5A)。SMu0629基因的表达在vicK-NP菌株中减少约40%(P < 0.02),atlA的表达减少约35%(P < 0.007)。更重要的是,如使用全细胞裂解物和表面蛋白的4% SDS提取物的SDS-PAGE和Western印迹分析所示,vicK的缺陷导致AtlA(107 kDa)加工为其成熟形式(79 kDa)的几乎完全抑制(图5B),并导致对自溶的显著抗性(图5C)。
有趣的是,从4% SDS提取部分明显看出,几种蛋白质的表达或定位在vicK突变体中显著受影响。特别值得注意的是,两个条带,大约150 kDa和70 kDa,在突变体中比野生型菌株数量多得多(图5B)。为了鉴定这两个条带,将它们从染色凝胶中切下,并通过基质辅助激光解吸电离-飞行时间质谱分析胰蛋白酶消化模式。较大的条带被鉴定为GtfC,较小的蛋白质被鉴定为与戈登链球菌推定N-乙酰胞壁酰胺酶/溶素和肺炎链球菌胆碱结合蛋白D同源的细胞壁蛋白前体蛋白(SMu0555)。因此,这些结果表明Vic系统直接或间接控制毒力因子的定位或表达,包括Gtfs和自溶素。
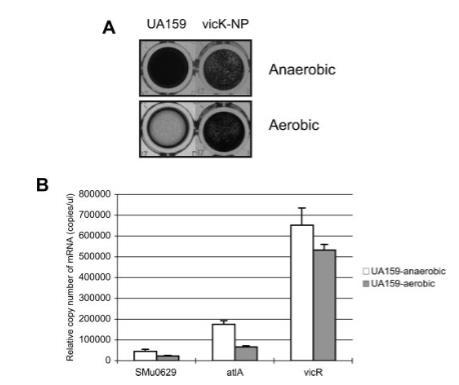
图6. 变异链球菌菌株(UA159和vicK-NP)需氧生长效应。需氧培养采用旋转摇床(150 rpm)进行。(A)生物膜形成。菌株在添加20 mM蔗糖的BM培养基中生长,通过结晶紫染色法在聚苯乙烯微孔板上检测生物膜形成情况。(B)采用实时荧光定量PCR技术检测需氧生长条件下变异链球菌UA159中SMu0629、atlA和vicR基因的差异表达。数据显示为三次及以上独立重复实验的平均值±标准差。*表示P<0.02(学生t检验)。
氧气对vicK突变体的影响。 有趣的是,与atlA突变体的情况相似,当细胞在通气条件下生长时,vicK突变体的长链和细胞聚集特征显著减弱,接近野生型水平。此外,在相同条件下,与野生型相比,vicK突变体在BM-蔗糖培养基中显示出显著增加的生物膜形成(图6A)。尽管vicK突变体的表型受氧气显著影响,但vicK基因的表达在氧气存在或不存在下没有差异(图6B)。然而,SMu0629基因(P = 0.05)和atlA(P = 0.003)的表达在氧气存在下显著降低(图6B)。
相关新闻推荐
1、嗜碱盐单胞菌菌株生理生化与生长特性、最优发酵条件——摘要、材料与方法
2、铜绿假单胞菌RccR在PA碳代谢和氨基糖苷类抗生素耐受性中的关键作用
3、A型塞内卡病毒全长感染性克隆、致病机理及生长曲线分析(一)
