3倍变化且p值<0.05)的顺时针和逆时针方向的蛋白质。红线表示在尼古丁培养基中上调的蛋白质,蓝线表示在甘油培养基中上调的蛋白质。圆圈3和圆圈4指示使用COG数据库分析的顺时针和逆时针方向的预测CDS(颜色根据COG功能类的颜色代码分配);圆圈5指示S16基因组中预测的基因组岛。红线代表S16中最大的基因组岛,其中尼古丁降解簇位于该圆圈中。圆圈6指示tRNA;圆圈7和圆圈8分别指示GC偏斜(G-C/G+C)值和GC含量百分比,使用4000-bp窗口大小和2000-bp重叠。[16](图2)。
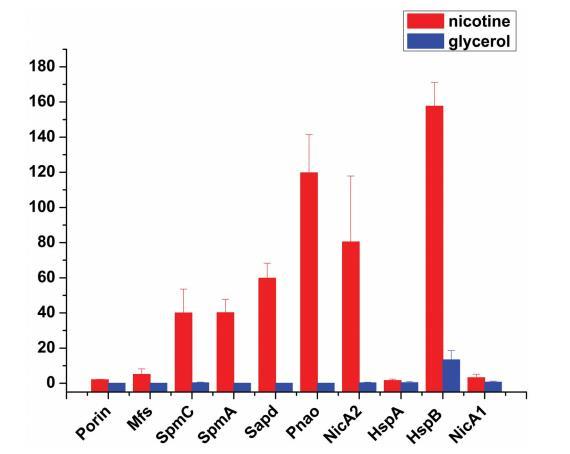
从外向内,圆圈1和圆圈2指示在尼古丁和甘油培养基中差异表达(>=3倍变化且p值<0.05)的顺时针和逆时针方向的蛋白质。红线表示在尼古丁培养基中上调的蛋白质,蓝线表示在甘油培养基中上调的蛋白质。尼古丁暴露引起S16菌株蛋白质组中与碳水化合物代谢相关的几种蛋白质丰度的变化(表S2)。NicA2(PPS_4081)、HspB(PPS_4061)(13)、Pnao(PPS_4080)[18]和Sapd(PPS_4079)在尼古丁条件下的丰度高于甘油条件,表明这些酶是尼古丁降解所必需的(表S2和图3)。有趣的是,两个最可能的尼古丁降解酶集(PPS_4077和PPS_4078)在尼古丁条件下显著上调,使它们成为负责尼古丁降解的可能基因。尼古丁培养物中酶NicA1(PPS_0381)的表达量约为甘油培养物中的5倍。此外,蛋白质HspA(PPS_0380)在尼古丁条件下的表达仍然与HspB(PPS_4061)不同,如先前报道[13](图3)。
尼古丁对恶臭假单胞菌S16膜蛋白质组表达的影响
在尼古丁存在下上调的除降解酶以外的其他蛋白质包括孔蛋白(PPS_4075)、主要协助子超家族代谢物同向转运蛋白(PPS_4076)、TolC家族I型分泌外膜蛋白(PPS_3866)、抗性-结节化-细胞分裂(RND)外排系统外膜脂蛋白(PPS_3077)、RND家族外排转运蛋白,MFP亚基(PPS_2905)、TetR家族转录调节因子(PPS_1707)和假设蛋白(PPS_4370, PPS_3191)(表S2)。在1 g l-1尼古丁中培养恶臭假单胞菌S16细胞导致几种外膜蛋白含量的改变,特别是孔蛋白和RND外排系统丰度的增加。PPS_4075的推导序列表明它是一种推定的外膜蛋白孔蛋白。这里鉴定的外膜孔蛋白的差异表达可能与适应环境压力有关。序列比对表明保守区域位于OprD中假定的跨膜结构域上。发现RND外排系统外膜脂蛋白(PPS_3077)、N-乙酰胞壁酰-L-丙氨酸酰胺酶(PPS_4740)、含TM螺旋重复蛋白(PPS_1651)和RND家族外排转运蛋白,MFP亚基(PPS_2905)在尼古丁暴露后增加。基因PPS_3077被提议为RND外排转运蛋白外膜脂蛋白,它可能将有毒有机溶剂输出到外部介质[19]。该亚基的含量在尼古丁暴露后增加(表S2),表明该外排泵是S16菌株适应尼古丁应激所必需的。
基因转录表达的验证
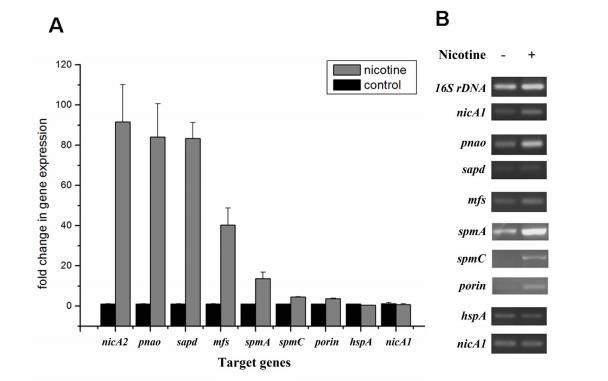
为了验证蛋白质组数据并评估与尼古丁降解相关或推测相关的基因的相对转录水平,我们利用RT-PCR和RT-qPCR比较了有或无尼古丁诱导下,恶臭假单胞菌S16中基因nicA2、pnao、sapd、mfs、spmA、spmC、porin、nicA1和hspA(推测与尼古丁降解相关)的mRNA水平(图4)。RT-qPCR分析显示,所有靶基因在尼古丁诱导的恶臭假单胞菌S16中似乎都上调。相对于非尼古丁诱导,在尼古丁诱导的恶臭假单胞菌S16中,与尼古丁降解途径相关的基因的mRNA表达量高出18.8至90.3倍,其中nicA2的mRNA上调90.3倍是所测试基因中mRNA水平差异最大的。spmA和spmC的mRNA也分别上调了13.6倍和4.5倍(图4A)。使用半定量RT-PCR也观察到类似的结果,这些基因中的每一个在尼古丁暴露后都被诱导,表明它们在S16菌株的尼古丁降解中起作用(图4B)。总体而言,这些数据表明通过RT-qPCR确定的mRNA水平与通过2D LC-MS/MS测量的蛋白质水平一致,并且差异表达的蛋白质在转录水平上受到调控。
新型尼古丁诱导蛋白SpmA、SpmB和SpmC的鉴定
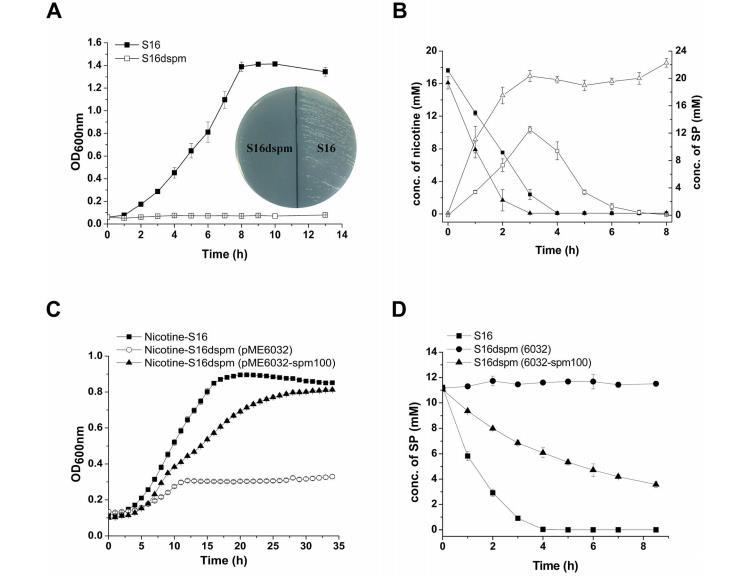
2D LC-MS/MS和RT-qPCR分析显示,spmA和spmC的蛋白质和mRNA水平在尼古丁诱导的恶臭假单胞菌S16中高表达,并且spmA、spmB和spmC基因产物与一些黄嘌呤脱氢酶家族成员(节杆菌属尼古丁vorans的尼古丁脱氢酶[20],恶臭假单胞菌86的喹啉2-氧化还原酶[21])的亚基显示出显著的序列同一性,表明这三个基因编码来自恶臭假单胞菌S16的SP单加氧酶的三个亚基。为了验证这一假设,通过在spmA中进行极性单同源重组构建了突变菌株恶臭假单胞菌S16dspm,并测量了其在尼古丁中的相关细胞生长和静息细胞对尼古丁的转化。破坏spmABC基因(spmA、spmB和spmC)不允许恶臭假单胞菌S16dspm以尼古丁作为唯一碳源和氮源生长(图5A)。此外,恶臭假单胞菌S16dspm的静息细胞将尼古丁完全转化为SP,但不能再转化SP,导致SP积累,而野生型恶臭假单胞菌S16的静息细胞可以催化SP转化为HSP(图5B)。这些数据表明spmABC基因编码将SP转化为HSP的SP单加氧酶。为了更牢固地确立这一结论,将包含spmA ATG上游100 bp的片段spm100克隆并在穿梭质粒pME6032-spm100中表达。当质粒pME6032-spm100转移到恶臭假单胞菌S16dspm时,重组菌株获得了以尼古丁作为唯一碳源和氮源生长的能力(图5C),并且也可以将SP转化为HSP(图5D和图S2)。上述数据表明spmABC的产物是负责将SP羟基化为HSP的单加氧酶。
mfs(PPS_4076)和sapd(PPS_4079)的功能分析
使用pK18mob质粒敲除编码Mfs基因的PPS_4076。我们发现突变体S16dmfs生长比野生型菌株S16差(图S3)。mys基因的缺失表明该基因对于正常的尼古丁降解很重要。有趣的是,当基因sapd被敲除时,突变体S16dsapd比野生型菌株S16生长慢。并且两者都能在尼古丁平板上生长良好(图S4)。
相关新闻推荐
1、龙脑精油3种组分对大肠杆菌生长曲线的抑制效果——材料与方法
2、不同浓度没食子酸对溶藻弧菌生长、电导率生、物被膜形成、泳动聚集能力的影响(二)
3、高密度发酵的过程中乙酸抑制重组大肠杆菌生长及外源基因的表达——结果
