长期共培养实验
长期实验中使用的NAS(新谷叶-Page改良Neff氏阿米巴盐水)培养基制备如下:将1克谷草粉(Aldon Corp.,Avon,NY)在1升去离子水中煮沸5分钟,然后通过玻璃纤维滤膜(GF/C,Whatman)过滤。冷却后,加入5毫升PAS储备溶液II和I,并用去离子水将最终体积恢复至1升。
实验前,将生物体分开培养并准备如下。对于细菌培养,将粘质沙雷氏菌菌株Db11的单个菌落接种到带膜滤器盖(corning)的聚碳酸酯锥形瓶中的80毫升NAS培养基中。将锥形瓶在25°C、120 rpm的旋转摇床上培养48小时。
收集阿米巴和纤毛虫细胞,用40毫升PAS(Page氏阿米巴盐水)离心(1200 x g,15分钟)洗涤两次。离心后,将细胞重悬于PAS中,并调整至最终浓度约为10个细胞/μL。
为了制备噬菌体储备液,从半融合平板上收集LB-软琼脂(0.7%),与LB培养基混合(每板4毫升),并在37°C下培养3.5小时。通过离心(9682 x g,5°C,20分钟)去除碎片。使用0.2μm Acrodisc®注射器过滤器(Pall)过滤储备液。将噬菌体储备液在NAS培养基中稀释1:100,000,得到约10^9 PFU/mL。
长期实验在带有0.2μm疏水滤膜盖(Sarstedt TC 83.1810.002)的25 cm²聚苯乙烯培养瓶中启动。根据群落组成,每个培养瓶接种1毫升相应的微生物,并用NAS培养基将总体积调整至15毫升。共有五种群落组成处理:(1)细菌;(2)细菌+纤毛虫;(3)细菌+阿米巴;(4)细菌+噬菌体;以及(5)细菌+所有三种敌害。每个处理重复36个培养瓶。
静态液体培养物在25°C下培养。每7天,彻底混合每个培养瓶的内容物,并用新鲜的NAS培养基更换50%的体积,使系统成为脉冲资源类型。在每次更新之前,从每个处理中随机选择四个培养瓶进行破坏性取样。
细菌生物量和原生动物种群大小的测量
从每个培养瓶的五个独立的400μL样品中测量自由水相的细菌生物量,使用蜂窝板2(Oy Growth Curves Ab Ltd Helsinki,Finland)。使用Bioscreen C®分光光度计(Oy Growth Curves Ab Ltd)在460-580 nm波长下测量光密度(OD)作为生物量。测量以5分钟为间隔重复10次。
为了测量附着在壁上的粘质沙雷氏菌生物膜的量,将15毫升的1%结晶紫溶液(Sigma-Aldrich St.Louis,Missouri,USA)注入培养瓶。10分钟后,用蒸馏水冲洗培养瓶三次,然后加入15毫升96%乙醇,将结晶紫从壁上溶解24小时。如上所述,通过结晶紫-乙醇溶液的吸光度量化形成的生物膜量。使用Bioscreen C分光光度计在460-580 nm波长下测量结晶紫-乙醇溶液的OD来量化形成的生物膜量。
噬菌体种群密度可以通过例如流式细胞术测量。然而,系统中噬菌体颗粒的总数并不是一个有意义的度量,因为噬菌体丰度并不能说明噬菌体对系统中存在的细菌基因型(或表型)的感染性。但是,我们通过从每个培养瓶取三个独立的500μL样品,确认了噬菌体在整个实验过程中存在于微观世界中。为了去除宿主细菌、阿米巴和纤毛虫,用氯仿处理样品,并以17,000 x g离心7分钟。然后将10微升上清液点滴到含有与200μL过夜生长的祖先Db11细胞混合的0.7%LB-琼脂上层的1.5%琼脂平板上,并将平板在25°C下培养过夜。整个实验过程中所有培养瓶的所有样品都在细菌菌苔上形成了噬菌斑,证实了噬菌体在实验期间没有灭绝。
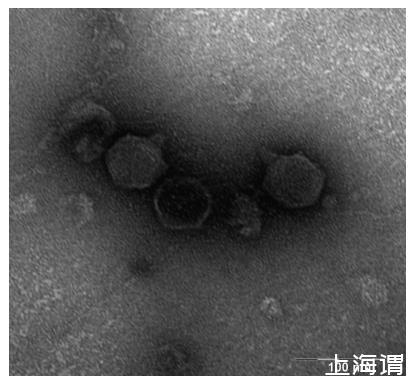
为了跟踪阿米巴的种群动态,小心地将培养瓶倒置,使用奥林巴斯SZX显微镜(Olympus Optical Co.,Ltd.Tokyo,Japan)(32倍放大)在暗场模式下从微观世界底壁数字化八个随机放置的图像(总面积18 mm²)。使用我们实验室为Image Pro Plus软件(v.7.0)开发的脚本计数每个图像中的细胞数。
为了确定纤毛虫密度,将250μL开放水样品与10μL卢戈氏溶液混合,然后注入玻璃比色皿(深度2.34 mm)中,以便纤毛虫细胞可以立即染色和固定。对于每个样品,使用奥林巴斯SZX显微镜(32倍放大)数字化八个随机放置的图像(总面积18 mm²)。使用Image Pro Plus脚本计数每个图像中的细胞数。
用噬菌体Semad11和细菌Db11进行的短期实验
将Db11在25°C的LB平板上培养48小时,将单个菌落接种到NAS培养基中。液体培养物在摇床(120 rpm)中于25°C培养48小时。将5微升细菌培养物接种到含有400μL NAS培养基的蜂窝板2(Oy Growth Curves Ab Ltd)的200个孔中。同时,向100个孔中加入5微升含有约10^4 PFU的噬菌体储备液(溶于dH2O中)。使用Bioscreen C分光光度计(Oy Growth Curves Ab Ltd)在460-580 nm波长下测量OD。测量以5分钟为间隔重复进行100小时。在测量结束时,从噬菌体处理的孔中确认了具有感染性的Semad11(使用祖先Db11)的存在。
统计分析
除了细菌的开放水和壁生物量以及原生动物密度外,我们还计算了开放水与生物膜生物量的比率以及系统中的总细菌生物量。这些响应变量在每周的取样中测量,每次取样为每个处理选择四个培养瓶进行破坏性取样。因此,我们使用ANOVA,其中时间和群落组合被视为因素(响应变量=群落+时间+群落x时间+误差)。需要时,对响应变量进行平方根或对数转换以满足分析假设。
使用Friedman检验和Wilcoxon符号秩检验比较不同细菌敌害和敌害组合在减少开放水和生物膜中细菌生物量方面的效率(样本量在所有比较中均为4)。
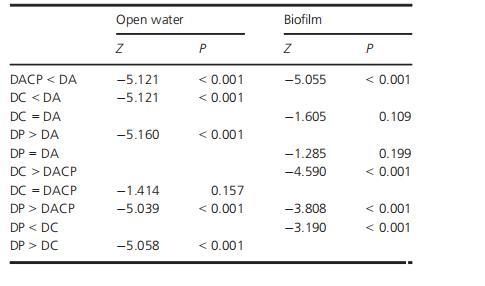
表1.Wilcoxon符号秩检验显示不同敌害组合在减少生物膜和开放水中细菌生长方面的效率。
所有分析均使用SPSS v.19(IBM New York,NY,USA.)完成。
