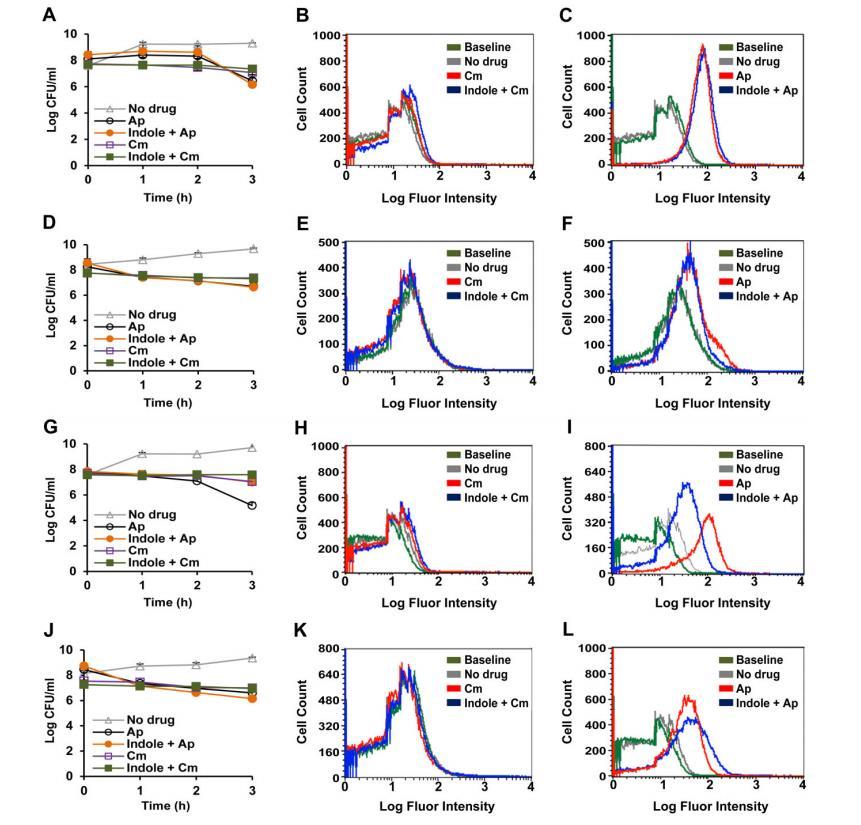
已有研究利用荧光染料HPF监测抑菌化合物诱导的体内荧光淬灭,我们进行了类似实验:在添加50%MIC浓度药物3小时后监测HPF荧光,该浓度和时间可保证野生型和突变体菌株100%存活。结果显示,氯霉素(图1B)、红霉素和四环素等抑菌化合物不会引起恶臭假单胞菌及其突变体的HPF荧光淬灭,这与大肠杆菌的实验结果一致;野生型DOT-T1E在氨苄西林(图1C)和诺氟沙星作用下出现HPF荧光淬灭。我们还检测了T1E-18、T1E-PS28和双突变体T1E-PS32的HPF荧光淬灭响应:100μg/mL氨苄西林即可诱导DOT-T1E-18的淬灭反应(图1I),该浓度是野生型菌株发生淬灭所需最低浓度的1/3;双突变体T1E-PS32在更低浓度(1/15)下即可诱导HPF荧光淬灭(图1L)。这些结果表明,尽管基于HPF淬灭模式和亲本菌株及突变体T1E-PS32的耐药性特征,TtgGHI外排泵在氨苄西林排出中的作用较弱(图1),但仍需将氨苄西林排出功能归因于TtgGHI——因为ttgABC/ttgGHI双突变体在远低于T1E-18的氨苄西林浓度下即发生HPF荧光淬灭,且对多种抗生素的敏感性更高。
杀菌化合物并非通过产生活性氧杀死恶臭假单胞菌DOT-T1E
已有研究表明,体内羟基自由基可淬灭HPF荧光;曾有观点提出大肠杆菌中杀菌抗生素通过产生羟基自由基发挥普遍杀伤机制(无论其具体细胞靶点如何),依据是杀菌化合物(而非抑菌化合物)处理的细胞中会出现HPF荧光淬灭。但近期研究反驳了这一解释,发现杀菌抗生素在无氧条件下仍可杀死大肠杆菌;与此一致,另有研究发现大肠杆菌并非对所有杀菌化合物都产生活性氧。
我们的结果显示,恶臭假单胞菌中杀菌和抑菌化合物引起的HPF荧光淬灭模式与上述大肠杆菌模式相似。我们进一步检测了氨苄西林处理后细胞是否激活氧化应激响应程序:通过转录组分析和实时定量聚合酶链式反应(qRT-PCR)分析多个氧化应激基因的表达,提取暴露于300μg/mL氨苄西林的DOT-T1E细胞总RNA并进行全局表达分析。结果显示,氨苄西林处理后57个基因表达上调,22个基因表达下调,但未发现氧化应激相关基因在氨苄西林存在下被调控;相反,与一般应激相关的基因(如recA和lexA)被诱导表达。为进一步验证芯片结果,我们通过qRT-PCR定量分析了烷基氢过氧化物酶(T1E_5238)、过氧化氢酶(T1E_3279和T1E_4765)、过氧化氢酶过氧化物酶(T1E_1753)和recA基因的诱导水平:氨苄西林存在下生长的细胞中氧化应激基因未被诱导(相对表达水平为0.88-1.4),而recA的表达上调了6倍。在对氨苄西林敏感性增强的恶臭假单胞菌DOT-T1E18中,氨苄西林处理也未诱导氧化应激基因表达。这些结果表明,氨苄西林不会导致活性氧(ROS)产生,也不会诱导氧化应激基因表达,但会诱导一般应激响应相关基因。
吲哚是种间信号分子
DOT-T1E的基因组分析未发现色氨酸酶同源物。为验证DOT-T1E是否通过其他途径产生吲哚,我们通过高效液相色谱-质谱(HPLC-MS)分析了恶臭假单胞菌DOT-T1E在含或不含色氨酸的基础培养基中生长后的培养上清液,未发现恶臭假单胞菌产生吲哚的迹象;而在大肠杆菌LK111的平行对照实验中,大肠杆菌在进入稳定期早期时产生的吲哚浓度可达400μM。
由于吲哚被描述为种内信号分子,我们进一步检测了大肠杆菌与恶臭假单胞菌突变体共培养是否会影响该土壤细菌的抗生素耐药性:在含色氨酸的LB培养基中培养大肠杆菌LK111及其同基因tnaA(色氨酸酶)突变体,将过滤后的培养上清液作为吲哚来源,通过抑菌圈实验检测其对DOT-T1E、T1E-18和T1E-PS28抗生素耐药性的影响(图2)。
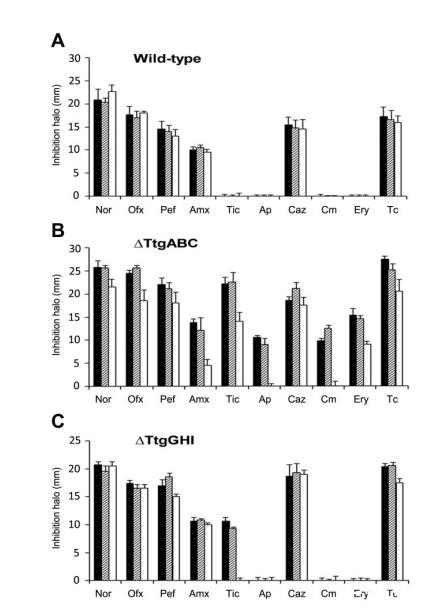
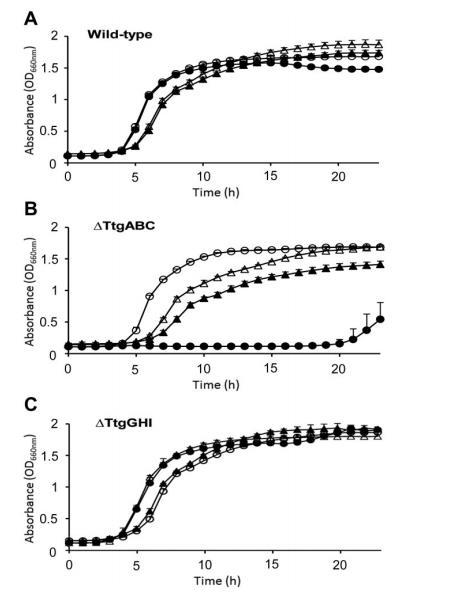
结果显示,亲本菌株(图2A)和T1E-PS28(图2A和C)在有无大肠杆菌培养上清液存在时的抗生素耐药性水平相似;在无培养上清液或添加tnaA突变体上清液时,T1E-18的抑菌圈大于亲本菌株,这种差异在替卡西林、氨苄西林和氯霉素作用下尤为显著(图2);而添加大肠杆菌LK111上清液后,T1E-18对所有抗生素的耐受性增强,耐药性水平与添加纯吲哚时相当。这表明肠杆菌产生的吲哚可有效促进恶臭假单胞菌的抗生素耐药性,通过监测恶臭假单胞菌的生长曲线进一步证实:200μg/mL氨苄西林可抑制DOT-T1E18的生长,而添加大肠杆菌上清液可缓解这种抑制效应(尽管细胞进入对数期前存在短暂延迟,且生长速率比无抗生素时慢20%)(图3)。
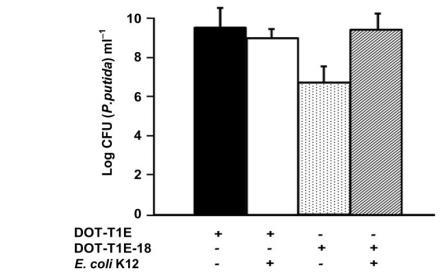
随后,我们检测了恶臭假单胞菌野生型、DOT1E-18与产吲哚大肠杆菌菌株在有无抗生素存在时的体内生长情况:将大肠杆菌与各恶臭假单胞菌菌株以相同细胞密度(10^5 CFU/mL)接种到不含抗生素或含氨苄西林的LB培养基中,以各菌株单独接种作为对照;通过在LB+氨苄西林+链霉素(大肠杆菌选择性培养基)上涂布计数大肠杆菌细胞数量,在LB+利福平上计数DOT-T1E,在LB+利福平+卡那霉素上计数T1E-18。结果显示,8小时后共培养物达到稳定期;在对照培养物和各共培养物中,大肠杆菌细胞密度均约为10^8 CFU/mL,DOT-T1E或T1E-18的细胞数量与之相近,表明无抗生素存在时各菌株的适应性相当。我们在300μg/mL氨苄西林存在下重复了上述共培养实验:大肠杆菌因质粒pMRS101携带bla基因而对该药物耐药,DOT-T1E菌株主要通过TtgABC泵排出抗生素而耐药,而T1E-18菌株的生长则受氨苄西林抑制(见图4);结果显示,只有当培养基中存在大肠杆菌LK111时,T1E-18才能在氨苄西林存在下生长(图4),表明种间信号传导具有功能活性,且恶臭假单胞菌可通过识别大肠杆菌产生的化学信号在含抗生素的培养基中增殖。