1.2.2生长曲线测定
在超净台中挑取纯化后的单菌落接种于TSB液体培养基(含10µg/mL NAD溶液)中,置于37℃摇床,180 r/min培养过夜,次日按照1%比例(体积比)转接于新TSB液体培养基(含10µg/mL NAD溶液)中,再放置于37℃摇床,180 r/min培养,分别在0、2、4、6、8、10和12 h时间点取出100μL菌液测定OD600nm值。
1.2.3溶血活性测定
将无菌绵羊血按照体积比5%比例加入TSA培养基(含10µg/mL NAD溶液)中,配制绵羊血平板。挑取临床单个菌落均匀地点在培养基上,每个菌4个重复,随后将平皿倒置在37℃恒温培养箱中培养18~24 h,观察是否有溶血情况以及溶血环大小。
1.2.4耐药性检测
从-20℃取出抗生素贮存液,解冻混匀后,取适量MH培养基稀释至适宜浓度。梯度稀释抗生素(第1孔200μL,其余各孔100μL MH培养基),第11孔加入菌液,第12孔为对照。每孔加入100μL菌液混匀,终浓度约5×105 CFU/mL。96孔板中,每孔中加入1×108 CFU/mL菌液100μL。37℃培养24 h后,根据2020版美国临床和实验室标准协会(CLSI)中的标准,首个澄清孔抗生素浓度为MIC(最小抑菌浓度),参考流感/副流感嗜血杆菌标准分析。
1.2.5大蜡螟模型初步筛选疫苗候选菌株
本研究使用大蜡螟和小鼠模型对分离菌株进行毒力筛选,首先用大蜡螟模型对菌株数量较多的血清1型、7型进行筛选,其他血清型菌株数量较少,直接进行后续小鼠筛选试验。将0.4~0.5 g大蜡螟幼虫分组,每组10只,注射APP血清型1型和7型菌液,设生理盐水组和空白对照组。注射剂量25μL/只,约1.0×106 CFU/只,37℃避光培养24 h,记录死亡情况(通体变黑且不动为死亡)。试验重复2次。初步筛选出毒力较强的血清1型和7型菌株。
1.2.6小鼠模型筛选高毒力疫苗候选菌株
将78只4周龄KM雌鼠随机分为13组,每组6只,采用腹腔注射进行感染,其中4组感染1型菌株(6×106 CFU/只),2组感染7型菌株(8×108 CFU/只),4组感染15型菌株(4×108 CFU/只),3组感染5型菌株(1×107 CFU/只)。观察3 d,统计小鼠死亡率和症状,选择各血清型毒力最强的菌株进行后续试验。
1.2.7疫苗候选菌株LD50(半数致死量)测定
将120只4周龄昆明雌鼠随机分成20组,每组6只。血清型1型菌株3-7选用1.6×107、8×106、4×106、2×106和1×106 CFU/只5个剂量进行攻毒;血清型5型菌株4-3选用4×107、2×107、1×107、5×106和2.5×106 CFU/只5个剂量进行攻毒。血清型7型菌株选用5×108、1.3×108、3×107、7.8×106和2×106 CFU/只5个剂量进行攻毒;血清型15型菌株选用1×109、5×108、2.5×108、1.3×108和6×107 CFU/只5个剂量进行攻毒。
同时设置对照组,注射等量生理盐水,均采用腹腔注射的攻毒方式,攻毒后观察3 d,统计死亡率,根据改进寇氏法计算LD50,计算公式为LD50=lg-1[Xm-i(∑P-0.5)](Xm—最大剂量的对数;i—组间距相邻两组对数剂量的差值;P—各组动物的死亡率;∑P—各组动物死亡率的总和)。
1.2.8疫苗候选菌株灭活疫苗的制备及免疫
将候选菌株进行复苏并传代,在TSB液体培养基中,培养至对数中期,6 000 r/min离心5 min,PBS洗3次后用PBS重悬。按总体积加入0.4%甲醛溶液,于37℃180 r/min振荡灭活24~48 h。灭活后取灭活菌液进行TSA平板划线,同时进行TSB培养基液体培养,进行灭活效果检测。根据试验设定的免疫剂量(单价疫苗剂量为菌株LD100的两倍;用PBS调整浓度,与铝佐剂1∶1配比,制成灭活疫苗,置4℃保存备用。使用6周龄Balb/c雌鼠作为实验对象,试验分组见表2。首次免疫记为第0天,第13天小鼠采血分离血清,第14天进行二免,第27天小鼠采血分离血清,第28天进行攻毒(各血清型候选菌株的LD100)。期间观察各组小鼠精神状况及死亡情况。同时设置阴性对照和商品化疫苗对照(猪传染性胸膜肺炎三价灭活疫苗),商品化疫苗含有1、2、7型菌,且每种菌抗原含量均≥5×108 CFU/mL,即≥1×108 CFU/只。
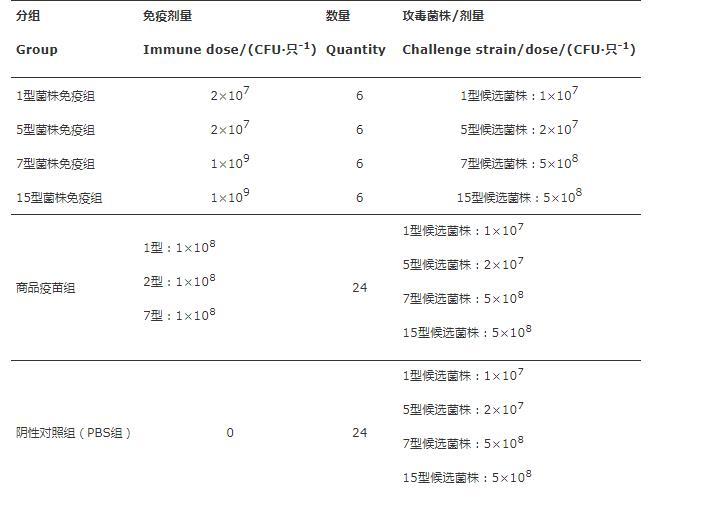
表2灭活疫苗免疫程序及免疫剂量
1.2.9抗体水平检测
全菌蛋白制备:将候选菌株进行培养至对数生长期,收集菌体并用PBS重悬,超声破碎后离心取上清即为全菌蛋白,BCA法测定蛋白浓度后液氮速冻保存。将候选菌株的全菌蛋白用包被液包被后,ELISA板中每孔加入100μL,4℃包被过夜。弃去包被液,每孔加200μL PBST洗涤液清洗3次。每孔加入300μL脱脂乳封闭液,37℃封闭2 h。弃去封闭液,PBST洗涤液清洗3次。每个样品用PBST将其稀释160倍后每孔加入100μL,37℃孵育1 h。弃一抗,PBST洗涤液清洗3次。用PBST按1∶3 000稀释羊抗鼠酶标二抗,每孔100μL,37℃孵育1 h。弃二抗,PBST洗涤液清洗3次。每孔加入100μL TMB底物显色液,37℃避光显色20 min,用酶标仪测定OD630nm处的吸光度。
1.2.10疫苗候选株传代稳定性检测
将筛选出的候选菌株接种于TSB液体培养基中,置于37℃摇床,180 r/min培养过夜,次日按照1%比例(体积比)转接于新TSB液体培养基中,再放置于37℃摇床,180 r/min培养。12 h后按1%比例(体积比)转接于新TSB液体培养基,为传代一次,按照此操作连续传代30次,使用候选菌株的10代、20代、30代菌株分别以致死剂量感染小鼠,每组6只,观察小鼠存活情况。
1.2.11数据统计学分析
本文所采用的统计学分析均使用GraphPad Prism 8.0软件计算各组数据的平均值和标准差,采用t检验对各组数据进行差异显著性分析。P>0.05为差异不显著(ns),P<0.05为差异显著(*),P<0.01为差异极显著(**),P<0.001为差异极显著(***)。
相关新闻推荐
1、系统性解析恶臭假单胞菌S16中尼古丁降解的分子机制(二)
3、新的微生物种间和跨界相互作用模式——操控自身的抗真菌化合物抑制邻近真菌的生长
