ET菌株的基因组序列。C.phytofermentans ET菌株基因组相对于WT菌株含有12个变异(表2),比具有相似乙醇抗性的C.thermocellum ET基因组(有200至500个变化)少得多(9)。虽然乙醇抗性可能是一个复杂的、多基因性状,但ET菌株基因组中数量较少的变化揭示了可能在乙醇耐受性中具有功能作用的DNA变异。12个突变中有两个位于编码转录调节因子的基因中,这些因子可能引起广泛的基因表达变化:PolB(DNA指导的RNA聚合酶的β亚基)和一个LysR调节因子Cphy3040。LysR型调节因子通常与其靶点共定位于基因组中(28),编码Cphy3040的基因与编码NAD依赖性醛脱氢酶的基因相邻,表明该调节因子与醇形成有关。
乙醇增加细胞膜的通透性,导致代谢物毒性泄漏出细胞(29)。因此,乙醇抗性通常涉及膜修饰,例如改变的蛋白质含量(8)或更长的链脂肪酸和更多的缩醛磷脂(30),以增加膜刚性来减轻乙醇的流体化效应。ET菌株在Cphy0233的推定酰基-受体结合口袋(NCBI登录号cd07989)中有一个D80N变化,Cphy0233是C.butyricum PlsD的同源物,PlsD在磷脂生物合成中将脂肪酰基转移到甘油-3-磷酸的sn-1位置(31)。Cphy0233突变因此可能通过改变掺入磷脂的脂肪酸来合成更刚性、耐乙醇的细胞膜。
ET菌株在膜结合Rnf复合物的RnfA亚基中有一个C26S突变,该复合物耦合H+(32)或Na+(33)外流与电子从还原型铁氧还蛋白转移到NAD+(34)。产生的电化学梯度被F0F1 ATP酶利用用于ATP合成。C.phytofermentans Rnf复合物(Cphy0211至Cphy0216)和F0F1 ATP酶(Cphy3735至Cphy3742)在所有测试的碳源上均高表达(19),并且可能对能量保存很重要,类似于C.ljungdahlii(32)。然而,Rnf产生NADH,这可能不能被ET菌株耐受,因为ET菌株无法通过AdhE介导的乙醇形成来重新氧化NADH(见下文)。因此,C26S RnfA变体可能使Rnf复合物功能受损,这牺牲了ATP生产,但可能通过平衡细胞NADH/NAD+比率而使ET菌株受益。
ET菌株在两种推定涉及阳离子稳态的转运蛋白中也有突变。Cphy0543与MgtA同源,MgtA是一种P型ATP酶,在低环境Mg2+浓度下上调(35),以介导Mg2+摄取(36)或Ca2+/Mg2+反向转运(37)。Cphy3780,一个ABC转运蛋白的膜组分(PFAM登录号PF06182),似乎与Cphy3780,一种ABC型Na+外排蛋白(NCBI登录号cd03267)共转录。在枯草芽孢杆菌中,这种Na+外排系统被乙醇诱导,并被提议用于补偿由于膜屏障减弱导致的细胞外Na+内流(38)。这些阳离子转运蛋白中的变异可能增加其活性以减轻乙醇胁迫导致的阳离子泄漏。
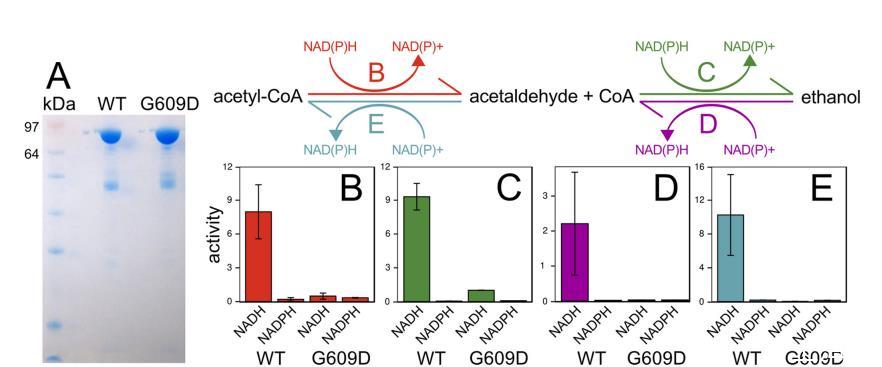
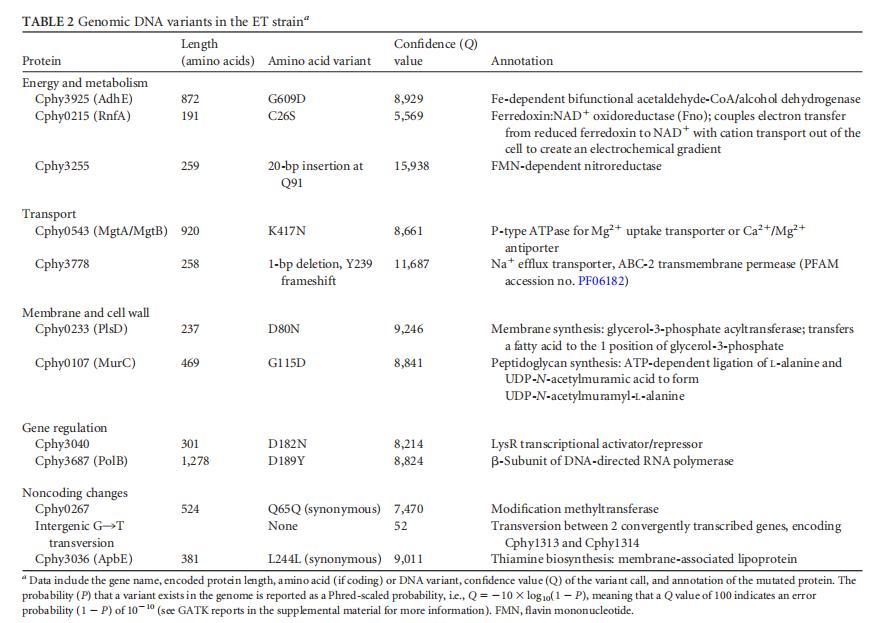
AdhE活性。ET菌株在Cphy3925 AdhE中有一个G609D变体,Cphy3925是一种推定的乙醛-CoA脱氢酶和醇脱氢酶(ADH)。G609D突变位于C末端ADH结构域(NCBI登录号cd08178)活性位点的保守位置。先前的一项研究报道了一株乙醇耐受的C.thermocellum菌株,其AdhE突变(P704L和H735R)将辅因子特异性从NADH转变为NADPH,这被提议通过改变内部氧化还原平衡来赋予乙醇抗性(9)。为了确定G609D突变对Cphy3925酶活性的影响,我们纯化了WT和ET版本的酶(图3A),并测试了它们使用NADH或NADPH辅因子体外催化乙酰-CoA转化为乙醇的两步、双向反应。
突变的Cphy3925失去了NAD(H)依赖性活性,但与C.thermocellum中的突变AdhE不同,G609D突变并未导致NADPH依赖性ADH活性(图3B至E)。相反,我们的结果支持ET菌株中止了AdhE介导的乙酰-CoA、乙醛和乙醇的相互转化,这有助于解释为什么C.phytofermentans ET菌株具有较低的乙醇产量。AdhE功能丧失可能通过降低细胞内乙醇及其高毒性前体乙醛的水平来减轻乙醇胁迫。C.phytofermentans除了Cphy3925外还编码四个铁依赖性ADH以及一个锌依赖性ADH。所有6个ADH均表达,并且Cphy3925和Cphy1029是在所有测试碳源上表达量最高的蛋白质之一(19,39)。因此,C.phytofermentans可能通过多个ADH的协同作用产生乙醇,而这些其他ADH,特别是Cphy1029,负责ET菌株产生的乙醇。
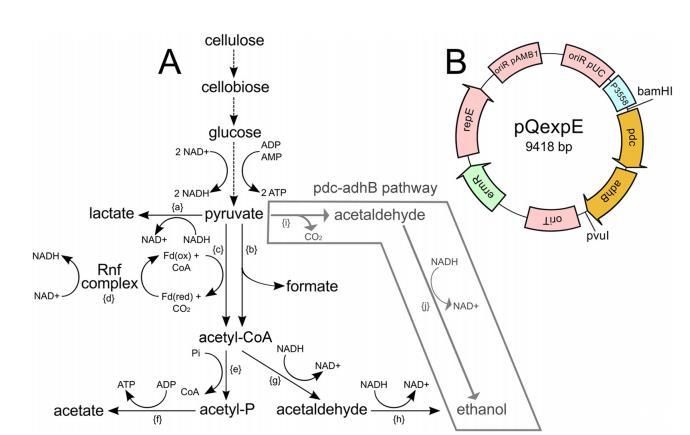
乙醇途径工程。为了增强ET菌株的乙醇生产,将来自Zymomonas mobilis的由丙酮酸脱羧酶(Pdc)和醇脱氢酶(AdhB)组成的替代乙醇生产途径(图4A)通过复制型pQexpE质粒(图4B)转移到C.phytofermentans中。这些酶共同将丙酮酸脱羧与乙醇偶联,并氧化NADH,因此代表了AdhE乙醇形成途径的替代方案。我们选择表达外源酶而不是WT拷贝的Cphy3925,因为AdhE会形成多聚体(40),因此突变型AdhE在部分二倍体中可能具有显性负效应。
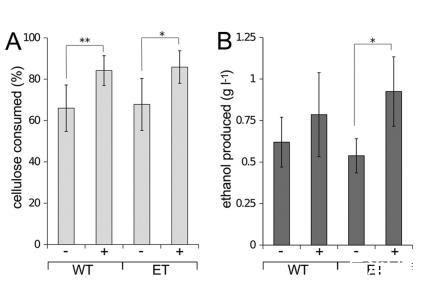
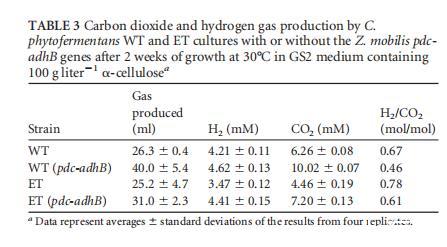
pQexpE的表达使WT和ET菌株的纤维素分解增加了约30%(图5A),并将乙醇产量相对于ET菌株提高了70%(P<0.01),从而将乙醇产量恢复到WT水平(图5B)。在表达pQexpE的WT和ET菌株中,CO2产量相对于H2产量不成比例地增加(表3)。CO2合成升高可能是由于Pdc酶催化的丙酮酸脱羧增加。先前的结果表明,Pdc/AdhB表达增强了WT C.cellulolyticum的纤维素分解和乙醇生产,这被提议是由于消耗了过量的丙酮酸,否则会导致代谢停滞(14)。表达Pdc/AdhB的C.phytofermentans代谢(纤维素分解以及CO2和乙醇产生)增加可能是由于缓解了过量丙酮酸的抑制。或者,糖酵解酶的表达或活性可能受NADH水平调节,使得Pdc/AdhB对NADH的再氧化刺激了糖酵解,从而导致底物利用增加。
结论
在本研究中,我们通过分离、表征和工程化一株乙醇耐受性(ET)的Clostridium phytofermentans菌株,探究了微生物乙醇耐受性的遗传基础及表型后果。ET菌株比野生型菌株能在更高的乙醇浓度下生长(图1),并且能在7%的环境乙醇浓度下持续产乙醇(图2C),但其生长(图1)和乙醇产量(图2A)相较于野生型有所受损。ET菌株的基因组测序揭示了涉及代谢多个方面的基因中存在12个突变(表2),包括双功能乙醛CoA/醇脱氢酶AdhE中的一个G609D变体,该变体使其活性丧失(图3)。我们通过在pQexpE质粒上表达Zymomonas mobilis的丙酮酸脱羧酶(Pdc)和醇脱氢酶B(AdhB)来补充ET菌株中的AdhE突变(图4),这促进了底物转化(图5A)并恢复了乙醇生产(图5B)。
需要进一步的工作来提高C.phytofermentans的植物生物质降解和乙醇形成速率及产物浓度。最近,通过实验进化改善C.phytofermentans在纤维二糖、纤维素和木聚糖上的生长,也获得了能更快生产乙醇的菌株(41)。本文提出的ET菌株基因组序列暗示了其他可能改善乙醇耐受性和生产的新的潜在方法。例如,我们的结果表明,关于乙醇抗性的进一步研究应侧重于PlsD介导的脂肪酸掺入磷脂、LysR调节的基因表达模式、过表达Rnf复合物以刺激AdhE介导的乙醇生产,以及防止阳离子泄漏。
相关新闻推荐
1、砷氧化菌株在砷胁迫中生长曲线测定及重金属铜的耐受性(二)
