为此,对生长曲线进行了广泛分析,使用了三种选定的生长模型。在此阶段仅考虑生长率,因为该参数对于同一微生物菌株的所有生长曲线应相似,即使从不同的初始接种量水平开始。分析了总共345条个体生长曲线,包括用于构建图1所示平均OD生长曲线的那些个体生长曲线。
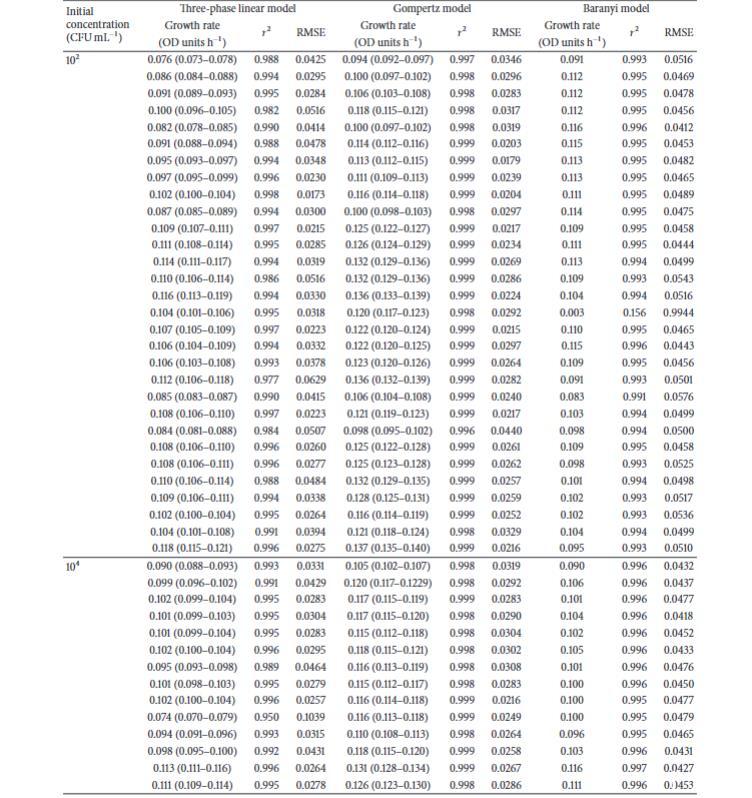
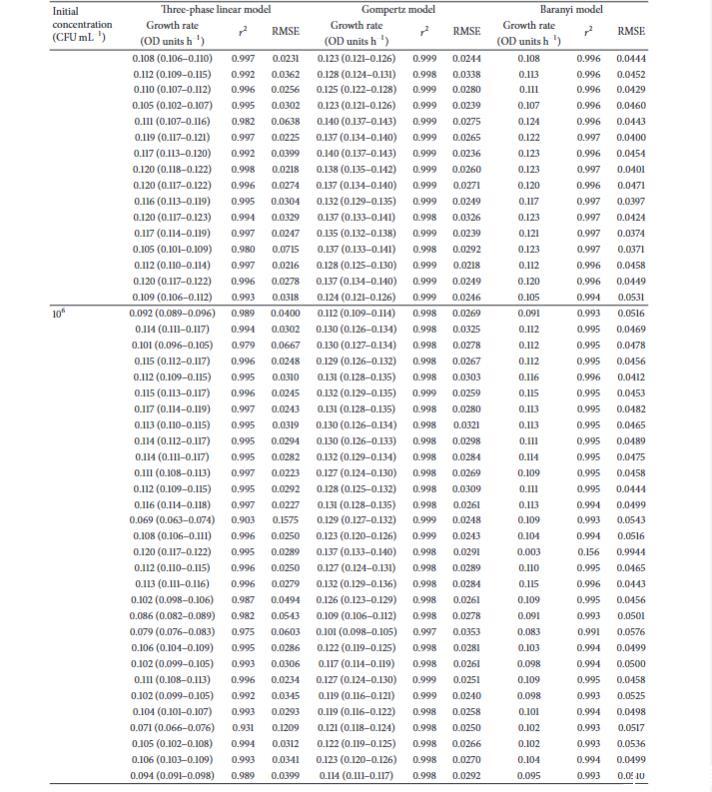
使用三相线性、Gompertz和Baranyi生长模型获得的所有大肠杆菌个体生长曲线的生长率值。利用这些数据以及蜡样芽孢杆菌和单核细胞增生李斯特菌个体生长曲线的数据,进行了广泛的统计分析,包括方差分析、中位数和四分位数。方差分析表明初始浓度不影响生长率,并且发现不同模型给出的生长率值之间存在显著差异,如前所述。统计分析还显示,在模型内部,生长率数据不是正态分布的,并且中位数生长率值之间也存在显著差异。
本研究的最后一步是分析生长率值的变异性。通过三相线性、Gompertz和Baranyi模型获得的所有三种微生物的生长率的平均值和标准偏差,图2显示了三种微生物生长率的箱线图。这些图基于中位数,并且比基于平均值的图更能抵抗异常值的扰动。
表2:使用不同生长模型对图1(a)所示蜡样芽孢杆菌INRA-AVTZ 415在30°C BHI中接种10°,10?和10?CFU mL?1的平均OD生长曲线获得的生长参数及其95%置信限以及决定系数(r2)、SSE和RMSE拟合。
表3:使用不同生长模型对图1(b)所示单核细胞增生李斯特菌CECT 4031在37°C TSB+YE中接种10°,10?和10?CFU mL?1的平均OD生长曲线获得的生长参数及其95%置信限以及决定系数(r2)、SSE和RMSE拟合。
表4:使用不同生长模型对图1(c)所示大肠杆菌CECT 515在37°C pH 5 TSB+YE中接种102,10?和10?CFU mL?1的平均OD生长曲线获得的生长参数及其95%置信限以及决定系数(r2)、SSE和RMSE拟合。
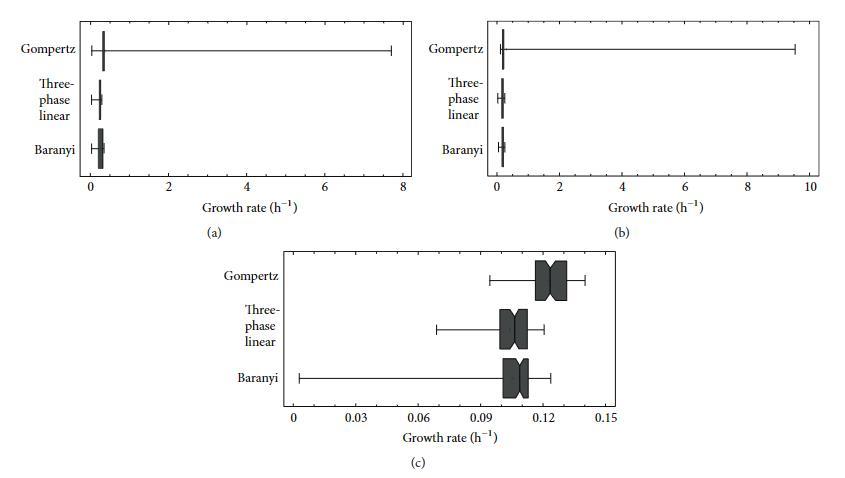
图2所示的结果清楚地显示,Gompertz模型在生长率值上具有比三相线性和Baranyi模型更高程度的变异性。Gompertz模型还生成了一些异常生长率值,这些值在蜡样芽孢杆菌和单核细胞增生李斯特菌的情况下将“须线”延伸了几个单位。当然,通过在执行非线性回归时更改初始值,可以获得这些异常值的正确值,但本研究的目的是优化模型,而是测试它们以选择性能最佳的模型。因此,未更改初始值。三相线性模型提供的变异性略低于Baranyi,尽管该模型的拟合优度比Baranyi模型差得多。
3.2.平板计数生长曲线
为了双重检查获得的结果,使用五种生长模型对这些相同微生物的几条平板计数生长曲线进行了建模。图3显示了蜡样芽孢杆菌INRA-AVTZ 415在30°C BHI中(a)、单核细胞增生李斯特菌CECT 4031在37°C TSB+YE中(b)和大肠杆菌CECT 515在37°C pH 5 TSB+YE中(c)以不同初始微生物浓度开始的平均对数CFU mL?1对每个采样时间绘制的生长曲线。如同平板计数生长曲线的通常情况,这些曲线每条包含较少的数据点,并且未在所有生长阶段显示数据点。通过这种方式,模型被迫进入数据点稀少的常见情况。三相线性、Gompertz、logistic、Richards和Baranyi模型对图3(a)、3(b)和3(c)所示蜡样芽孢杆菌、单核细胞增生李斯特菌和大肠杆菌生长曲线提供的生长参数。
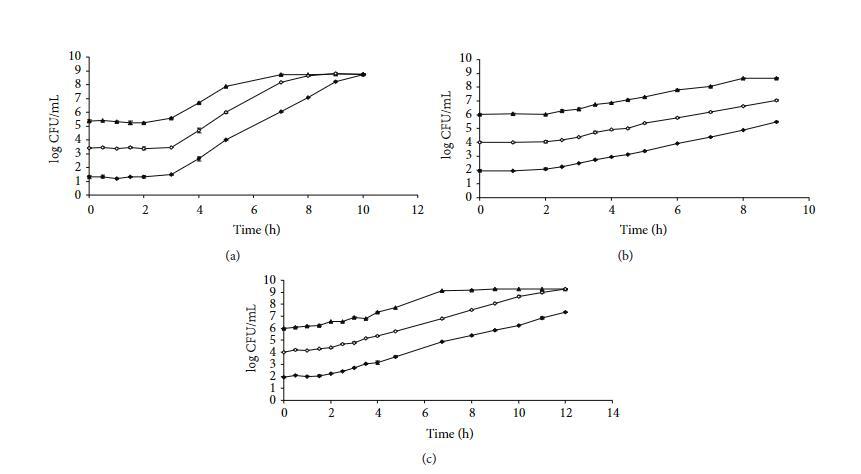
当建模来自平板计数生长曲线的数据时,获得了与吸光度数据类似的结果。三相线性模型给出了生长率和延迟时间的最低值,其次是Baranyi、Gompertz和logistic,按此顺序,对于所有三种微生物。对于这些平板计数生长曲线,Richards模型无法为任何曲线的生长率提供满意的值。值得注意的是,一些生长曲线未达到稳定生长阶段,并且三相线性和Baranyi模型在这些情况下未提供最大种群水平值,而所有其他模型对该参数提供了不确定的估计。
再次,三相线性是拟合优度最差的模型,r2值低至0.92,RMSE值高达0.49。
使用三相线性、Gompertz、logistic和Baranyi模型通过平板计数生长曲线获得的所有三种微生物的生长率的平均值和标准偏差。再次,当比较生长率值的相似性时,三相线性是给出不同生长曲线变异较小(较低标准偏差)的模型。
文献中报道的不同生长模型行为比较得出了不同的结论。Zwietering等[3]研究了植物乳杆菌在不同温度下的MRS培养基中的生长,并得出结论Gompertz模型是最佳拟合模型。当这些作者[3]将研究扩展到几种微生物时,他们得出了类似的结论。Buchanan等[2]报道,在成功拟合生长曲线数据方面,三相线性模型比Gompertz和Baranyi模型更稳健。在他们的研究[2]中,他们拟合了大肠杆菌O157:H7的实验数据。Schepers等[27]发现Richards模型是用于在不同pH值下生长的瑞士乳杆菌的最佳生长模型,Dalgaard和Koutsoumanis[7]也同意Richards模型为从变质海鲜中分离的不同微生物菌株混合物并在不同条件下培养以获得广泛生长产率的吸光度生长曲线提供了最佳估计。López等[5]在经过详细统计评估后得出结论,Baranyi模型对研究的生长曲线表现出最佳行为。
Baranyi和三相线性模型对在不同pH、温度和CO?条件下生长的耶尔森菌属的平板计数数据显示了最佳拟合。Richards模型是用于在不同条件下生长的不同细菌和真菌物种的光密度数据的最佳拟合模型。然而,Mytilinaios等[12]最近发现Baranyi是拟合在不同温度和pH值下获得的单核细胞增生李斯特菌光密度数据的最有能力模型。Weibull模型也充分描述了微生物生长[5]。Baty和Delignette-Muller[4]发现Baranyi是大多数曲线的最佳曲线拟合模型,尽管他们注意到模型间变异性通常比由于用于构建生长曲线的数据数量和质量低而导致的参数估计不精确性小。实际上,这些作者使用的低质量数据对应于Buchanan等[2]工作中制表的数据集。Pal等[28]也显示Baranyi模型为在液体培养中低温下获得的单核细胞增生李斯特菌的大多数生长曲线提供了最佳拟合,尽管所有分析的初级生长模型之间没有显著差异。也许使用这么多在不同生长条件下生长的微生物可以至少部分地解释作者关于最佳拟合模型的结论的差异。
4.结论
我们的结果表明,Baranyi模型和三相线性模型在分析相似生长曲线时,都为生长率值提供了较低的变异性,因此是首选模型。三相线性模型给出了生长率的最低变异,而Baranyi模型给出的变异略高,尽管其整体拟合效果要好得多。
这些结果增进了对预测微生物学的理解,并将帮助食品微生物学家和研究人员选择合适的初级生长预测模型。
致谢
本研究由西班牙政府经济与竞争力部以及欧洲区域发展基金(FEDER)通过项目AGL2010-19775和AGL2013-48993-C2-1-R提供财政支持。
相关新闻推荐
2、基于Bioscreen C的丝状真菌生长曲线分析方法优化与验证(一)
