2结果与分析
2.1 Tn5转座子插入位点鉴定结果
在D.zeae MS1的Tn5转座子插入突变体库中筛选到XT20、C45、XT120和Q63这4个毒力减弱突变体,突变体基本丧失致病性(Tn5插入sucA基因突变体对香蕉的毒力变化,已提交至国家微生物科学数据中心,编号为NMDCNMDCX0001751,https://nmdc.cn/resource/attachment/detail/NMDCX0001751)。该4个Tn5转座子插入突变体在刚果红-考马斯亮蓝培养基上表现出较为相似的表型,相较于野生型,均表现菌落变小、边缘平滑且颜色变浅(Tn5插入sucA基因突变体在刚果红-考马斯亮蓝平板上的菌落形态变化,编号为NMDCNMDCX0001751)。使用突变体的基因组DNA进行TAIL-PCR扩增、测序发现,Tn5转座子在该4个突变体中均是插入了同一个基因sucA的不同位点:XT20,第1 870 bp;C45,第1 923 bp;XT120,第2 241 bp;Q63,第2 373 bp(图1A)。在D.zeae MS1基因组中,sucA基因的开放阅读框(open reading frame,ORF)长度为2 808 bp,编码935 aa组成的α-酮戊二酸脱氢酶组分;该基因与D.dadantii 3937菌株的sucA基因序列具有89%的同源性。sucA基因广泛分布于肠杆菌目不同科的细菌中,SucA蛋白序列的系统发育树分析表明迪克氏菌属(Dickeya)菌株和果胶杆菌属(Pectobacterium)菌株的遗传距离最近且可聚成一个遗传分支,该遗传分支与欧文氏菌属(Erwinia)、埃希氏菌属(Escherichia)、克雷伯氏菌属(Klebsiella)、肠杆菌属(Enterobacter)等的代表性菌株可明显得到区分(图1B)。
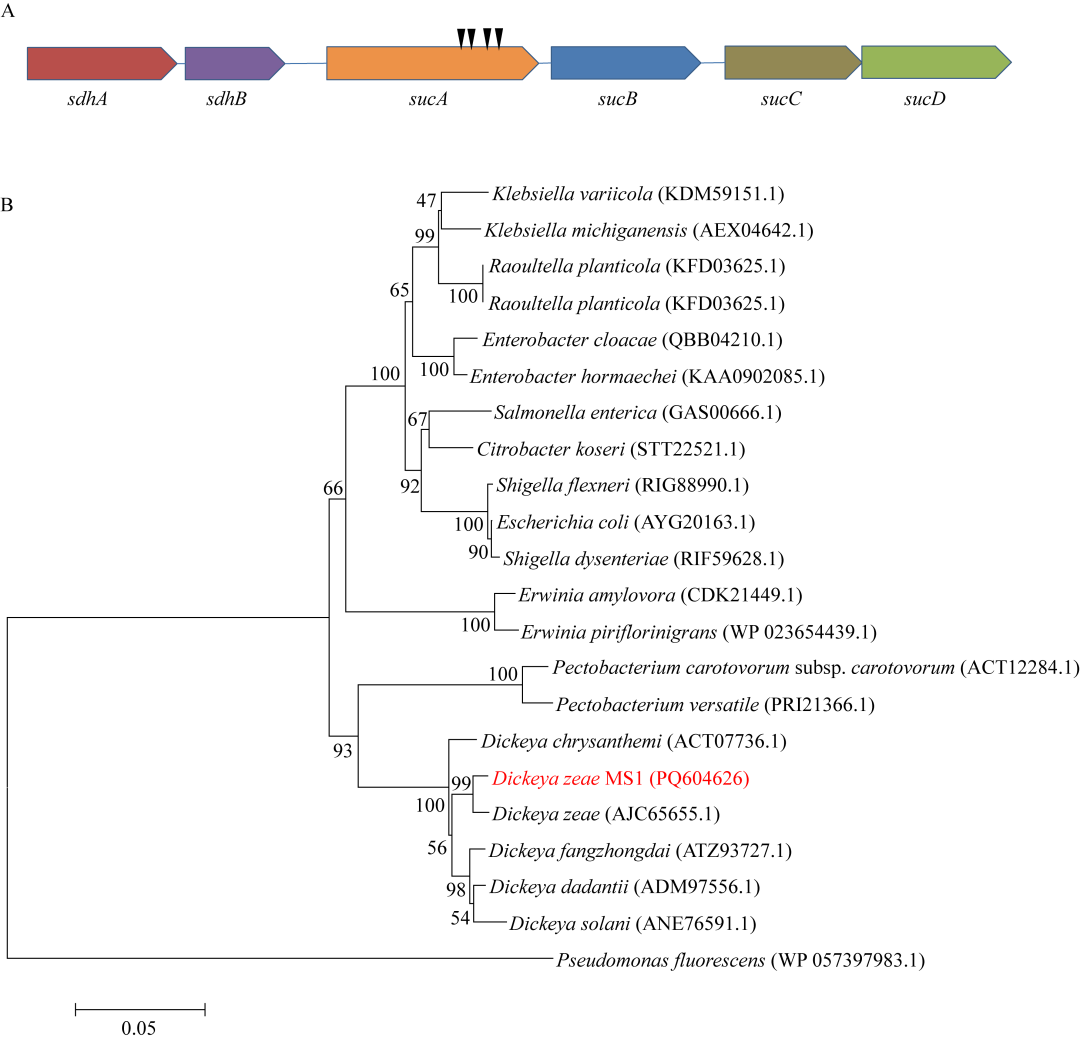
图1 Tn5转座子插入的sucA基因及其系统发育树分析A:示意图显示Tn5转座子插入D.zeae MS1 sucA基因的不同位点,黑色箭头从左至右分别表示突变体XT20、C45、XT120和Q63的插入位点;B:基于SucA蛋白序列的系统发育树分析,菌株拉丁名后括号内是GenBank序列号,分支点上的数字代表该其bootstrap值(以百分比形式展示),标尺数字代表该长度的分支所代表的基因遗传变异度。
小结
TAIL-PCR鉴定出4个D.zeae MS1的毒力减弱突变体的转座子插入位点均是位于α-酮戊二酸脱氢酶基因sucA内,该基因编码三羧酸循环过程的关键酶组分。
2.2 sucA基因突变对α-酮戊二酸脱氢酶活性和细菌生长的影响
相较于D.zeae MS1野生型,基因敲除突变体ΔsucA的α-酮戊二酸脱氢酶活性完全丧失,这与该基因预期的生物功能一致;回补菌株C-ΔsucA的α-酮戊二酸脱氢酶活性则可恢复至与野生型相近的水平(图2A)。在对细菌生长的影响方面,研究发现ΔsucA在LB培养基内细菌生长密度较野生型和回补菌株表现出一定程度的降低;在生长平台期时ΔsucA培养物的OD600为1.50−1.60,野生型和C-ΔsucA的OD600分别为2.06−2.20和1.95−2.08(图2B)。当细菌在MM培养基中培养时,ΔsucA在前期表现出一定程度的生长延迟;在生长14 h后达到生长平台期时,ΔsucA达到与野生型和C-ΔsucA接近的细菌生长密度(图2C)。sucA突变可完全破坏D.zeae MS1的α-酮戊二酸脱氢酶活性,但仅在一定程度上影响细菌生长。
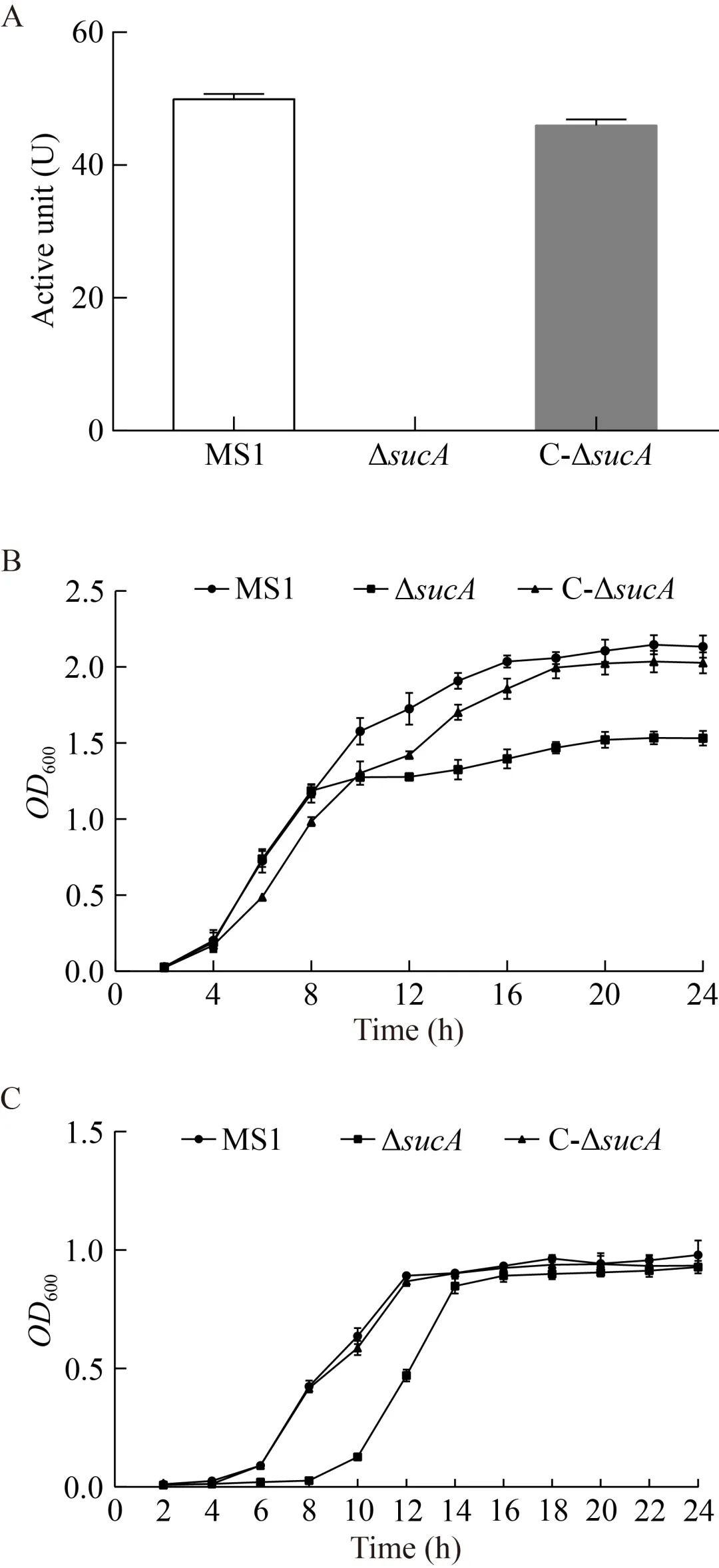
图2细菌的α-酮戊二酸脱氢酶活性和生长曲线A:D.zeae MS1野生型、基因敲除突变体ΔsucA和回补菌株C-ΔsucA的α-酮戊二酸脱氢酶活性差异;B:细菌在LB培养基内培养的生长曲线差异;C:细菌在MM培养基内培养的生长曲线差异。
小结
基因敲除突变体ΔsucA在细菌生长曲线上受到一定程度的影响,但是其α-KGDH活性完全丧失。
2.3 sucA基因突变降低PCWDEs的分泌
相较于D.zeae MS1野生型,ΔsucA在测定平板培养后的Cel、Pel和Prt的活性分别降低了44.25%、40.60%和97.48%,差异达到显著水平(P<0.05);C-ΔsucA菌株则将PCWDEs活性恢复至与野生型相似的水平(图3A−3C)。sucA基因对于香蕉细菌性软腐病菌分泌PCWDEs具有重要作用,RT-qPCR分析也表明sucA基因突变可影响编码PCWDEs基因的转录表达。相较野生型,编码Pel的基因pelB和pelC在ΔsucA中的转录水平显著降低;但是,sucA基因的突变对编码Cel的bglA和celH基因、编码Prt的prtE和prtF基因的转录表达均不产生明显的抑制作用(图3D)。
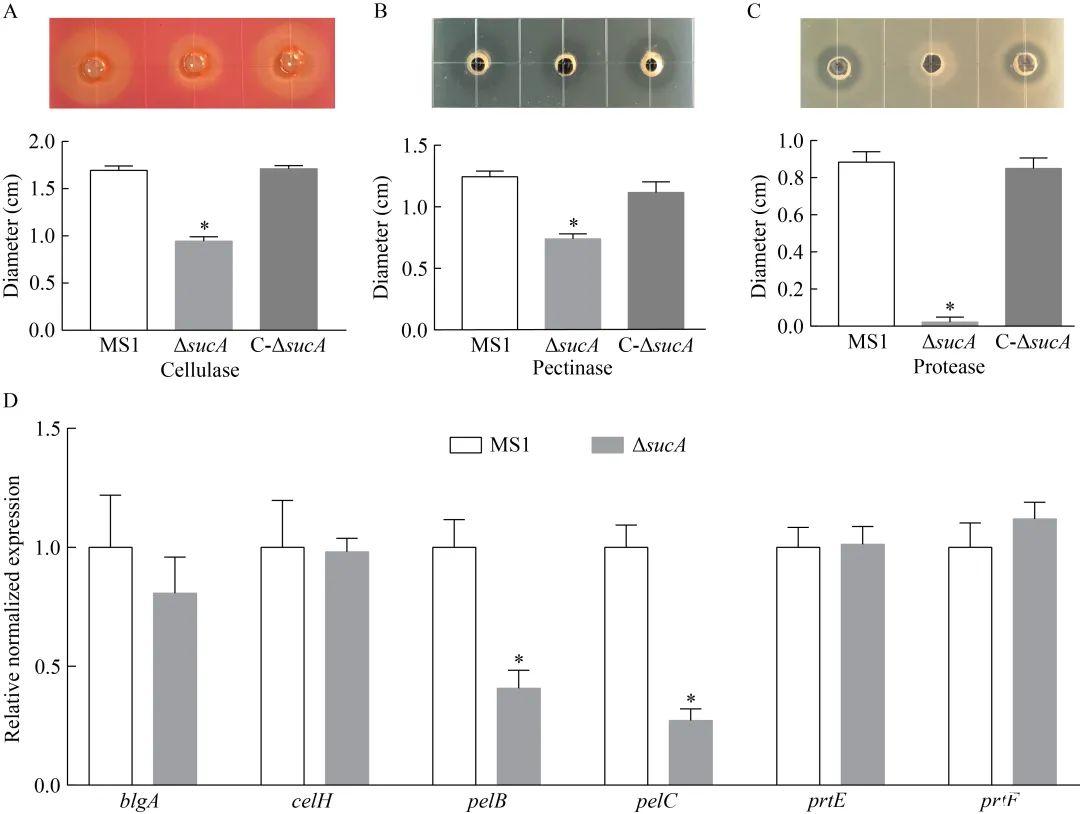
图3植物细胞壁降解酶分泌及相关基因表达的差异A:D.zeae MS1野生型、基因敲除突变体ΔsucA和回补菌株C-ΔsucA的纤维素酶活性;B:果胶裂解酶活性;C:蛋白酶活性;D:植物细胞壁降解酶编码基因的转录表达,blgA和celH编码Cel,pelB和pelC编码Pel,prtE和prtF编码Prt。
2.4 sucA基因突变不影响细菌运动性
在细菌运动性方面,D.zeae MS1野生型表现出良好的涌动性和游动性。相较于野生型,ΔsucA的涌动性和游动性均表现出相似的运动水平,回补菌株C-ΔsucA也呈现与它们相似的细菌运动能力(图4)。sucA基因的敲除突变并未降低细菌的涌动性和游动性。
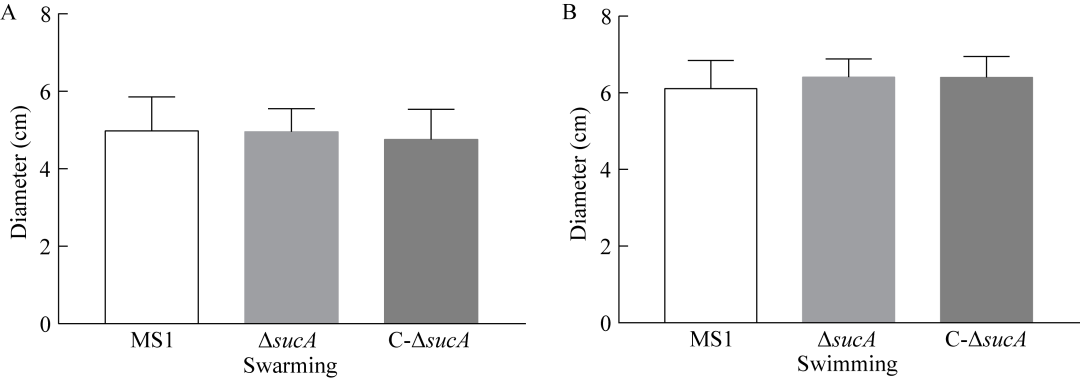
图4细菌运动性A:涌动能力;B:游动能力。
小结
sucA基因突变可显著减少PCWDEs的分泌并降低pelB和pelC等基因的转录表达,而不影响细菌的涌动、游动能力。
2.5 sucA基因突变可影响细菌的毒力
在对非寄主烟草的过敏性反应上,D.zeae MS1野生型在浸润接种至烟草叶片后可产生组织坏死等典型的过敏性反应,接种ΔsucA的烟草叶片仅表现出微弱的过敏性反应,两者间的反应差异明显(图5A);C-ΔsucA可恢复突变体在烟草上诱导产生过敏性反应的能力。在对寄主香蕉的致病性反应上,接种D.zeae MS1野生型和C-ΔsucA的香蕉幼苗在3 d后均可呈现出细菌性软腐病症状,具体表现为假茎基部变褐和新叶开始失绿;在接种7 d后,多数香蕉幼苗均已呈现明显的症状,具体表现为假茎腐烂、变黑并出现水渍状病斑,新叶也表现出明显枯萎甚至整叶坏死(图5B)。相反地,接种ΔsucA的香蕉幼苗在7 d后仍然表现整株健康,在接种处未出现明显的细菌性软腐病症状(图5B)。接种7 d后,香蕉幼苗发病严重程度的等级划分表明野生型和回补菌株可引起全部已接种幼苗出现症状,7株接种野生型的幼苗达到了3级以上的症状,5株接种回补菌株的幼苗达到了3级以上的症状;接种ΔsucA的幼苗则均未出现症状(0级)(图5C)。接种野生型和回补菌株的香蕉幼苗的病情指数分别为62.50%和60.00%,接种ΔsucA的幼苗的病情指数为0。
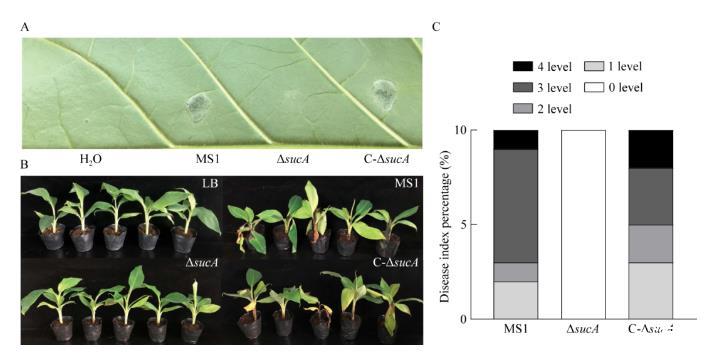
图5细菌的过敏性反应和致病性反应测定A:D.zeae MS1野生型、基因敲除突变体ΔsucA和回补菌株C-ΔsucA接种烟叶24 h后的过敏性反应;B:细菌接种香蕉幼苗7 d后的致病性反应;C:接种7 d后香蕉幼苗发病严重程度分级的分布,0–4代表发病严重程度的不同等级。
小结
相较于野生型,ΔsucA在烟叶上产生的过敏性反应明显减弱,对香蕉幼苗的致病性也显著降低。回补菌株则可将上述细菌表型均恢复至与野生型接近的水平。
相关新闻推荐
2、自然发酵鲊肉粉中筛选乳酸菌和葡萄球菌生长曲线及生物学特性(二)
