1.2 方法
1.2.1 AIH小鼠模型的建立
饲养ST2敲除小鼠和C57BL/6J小鼠4~6周后,ST2敲除小鼠和C57BL/6J小鼠分别经尾静脉注射ConA(20 mg/kg),8 h后眼球取血,脊椎脱臼法处死,取肝脏。模型的构建及验证在课题组前期工作中已被证实。
1.2.2 血清 ALT及AST测定
4 ℃、12 000 r/min、离心5 min血液2次后,取血清,采用酶比色法在德国罗氏公司cobas 702全自动生化分析仪测定小鼠血清ALT及AST浓度。
1.2.3 肝脏病理HE染色
从处死的小鼠中取肝脏组织约50 mg并固定在10%磷酸盐缓冲甲醛中。然后将样品转移至不同浓度的乙醇和二甲苯中。切片嵌入石蜡并进行HE染色。载玻片制备如下:载玻片用1%甲苯胺蓝复染5 min,并用蒸馏水洗涤,然后使用分级系列乙醇洗涤脱水。加入血红素溶液,用水和盐酸乙醇洗涤后将载玻片维持5 min。然后将切片在37 ℃下用伊红溶液染色5 min,用乙醇脱水并浸入二甲苯中。最后,将载玻片安装在玻璃盖玻片下,并在光学显微镜下进行观察及拍照。
1.2.4 实时荧光定量PCR(RT-PCR)分析
使用苯酚-氯仿法抽提取小鼠肝脏的总RNA,使用逆转录试剂盒逆转录获取cDNA,逆转录条件为:在总RNA样本中加入Oligo(dT)引物后充分混匀,PCR仪65 ℃扩增5 min;待反应完成后按试剂说明书加入dNTP、逆转录酶及RNA酶抑制剂等,在PCR仪上42 ℃反应60 min,70 ℃反应5 min后4 ℃保存。目标基因表达水平的检测采用SYBR Green法,以cDNA为模板,扩增条件:95 ℃预变性30 s;随后95 ℃变性10 s,62 ℃退火30 s,重复40个循环。以β-actin为内参基因,采用2-ΔΔCt法计算目标基因的相对表达水平。
1.2.5 肠道菌群测序
根据试剂盒说明书,采用QIAamp® DNA Stool Mini Kit提取小鼠肠道粪便的总基因组DNA,使用16S rRNA通用引物338F(5′- ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGA- CTACHVGGGTWTCTAAT-3′)进行扩增。纯化后的扩增产物使用MiSeq测序仪进行测序。
1.2.6 肠道菌群多样性分析
测序结果采用Microbial Ecology相关软件和数据库进行分析,包括Prinseq、FLASH、PEAR、Mothur、Usearch、Cytoscape、R和RDP classifier等软件,RDP、Silva和NCBI 16S database等数据库。Chao、ACE、Shannon和Simpson指数由Mothur软件计算产生。菌属多样性分析采用RDP classifier分析软件。菌群分布采用STAMP软件分析。
1.3 统计学分析
采用Graphad Prism 8.0软件作图。采用SPSS26.0软件进行统计分析,数据采用
±s表示,组间资料比较采用两独立样本t检验,以双侧P<0.05为差异具有统计学意义。
2 结果
2.1 敲除ST2基因表达可减轻ConA诱导的肝炎小鼠肝损伤和炎症
采用ConA将敲除ST2基因小鼠(ST2-/-组)和C57BL/6J小鼠(Control组)诱导成AIH小鼠。结果显示与对照组相比,敲除ST2基因小鼠血清中ALT和AST水平降低(P<0.05,图1A)。同时,对小鼠肝脏进行HE染色,染色结果显示肝脏呈现典型的界面性肝炎、淋巴细胞浸润,符合ConA诱导的AIH小鼠模型,并且发现敲除ST2基因的小鼠肝脏病理损伤较轻(图1B)。最后,对小鼠肝脏中IL-1β、IL-6、IL-17和IFN-γ等基因的相对表达量进行检测,结果显示敲除ST2基因表达后IL-6的表达量降低(P<0.001,图1C),其他细胞因子表达差异无统计学意义(P>0.05)。
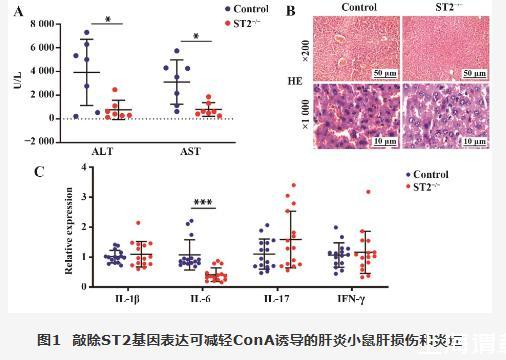
图1 敲除ST2基因表达可减轻ConA诱导的肝炎小鼠肝损伤和炎症
2.2 肠道菌群丰度和α多样性分析
采用ACE、Chao、Richness、Shannon和Simpson指数对小鼠肠道菌群的丰度和α多样性进行分析,结果显示ACE、Chao、Richness、Shannon和Simpson指数在Control组和ST2-/-组之间差异无统计学意义(图2A~J)。表明在AIH小鼠体内敲除ST2基因表达不影响肠道菌群的分布丰度及α多样性。
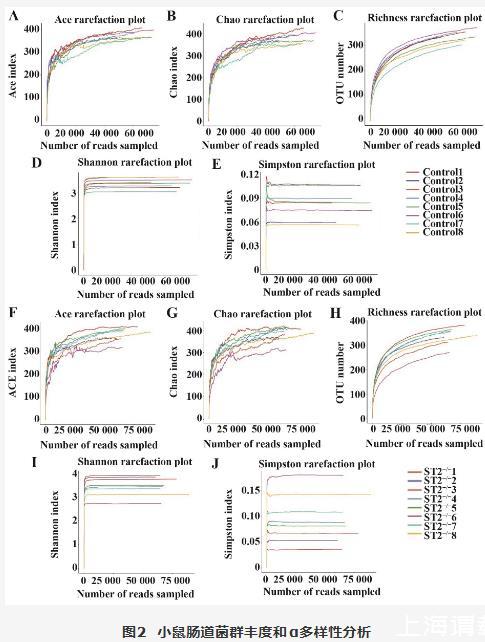
图2 小鼠肠道菌群丰度和α多样性分析
2.3 肠道菌群β多样性分析及LEfSe分析
利用PCA对小鼠肠道菌群的β多样性进行分析,结果显示,Control组和ST2-/-组小鼠肠道菌群的物种组成无明显差异(图3)。LEfSe分析可以检测到各组小鼠肠道有显著差异的菌群,如图4A、B,设定LDA值为4进行LEfSe分析可得Clostridia、Clostridiales、Lachnospiraceae、unclassified_Lachnospiraceae、BacillalesStaphylococcus、Staphylococcaceae、Saccharibacteria_ genera_incertae_sedis、norank_Candidatus_Saccharibacteria、norank_Candidatus_Saccharibacteria、Candidatus_Saccharibacteria、norank_Candidatus_Saccharibacteria、unclassified_Clostridiales、unclassified_Clostridiales和Clostridium_XVIII在Control组和ST2-/-组差异具有统计学意义(P<0.05)。
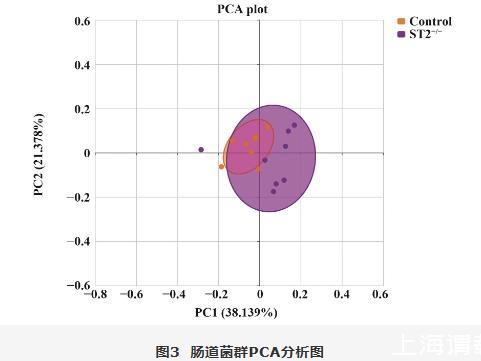
图3 肠道菌群PCA分析图
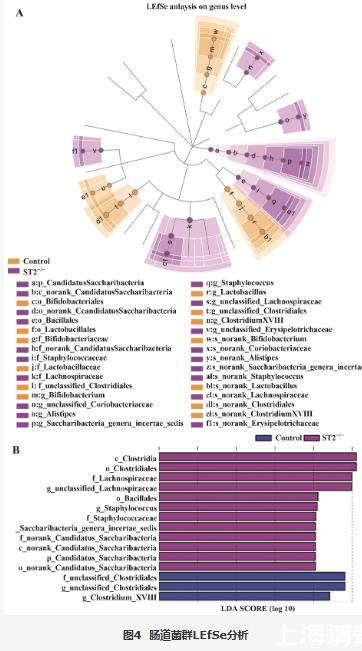
图4 肠道菌群LEfSe分析
2.4 肠道菌群种属差异分析
为进一步观察ST2敲除后对哪些菌群产生影响,对小鼠肠道菌群的种属差异进行分析。结果显示,正常小鼠诱导的肝炎小鼠肠道菌群中占主要的菌属是unclassified_Porphyromonadaceae(22.02%)、Akkermansia(17.87%)和Lactobacillus(14.81%)(图5A),而ST2敲除小鼠诱导的肝炎小鼠肠道菌群中占主要的菌属是unclassified_Lachnospiraceae(25.36%)unclassified_Porphyromonadaceae(21.82%)、Akkermansia(12.07%)(图5B)。Psychrobacter(P=0.045)、Romboutsia(P=0.037)、Rikenella(P=0.036)、unclassified_Clostridia(P=0.030)、Halothiobacillus(P=0.028)、Parabacteroides(P=0.025)、Clostridium_XlVa(P=0.024)、Haemophilus(P=0.018)和unclassified_Clostridiales(P=9.40e-3)菌属在Control组和ST2-/-组之间差异具有统计学意义(图6)。
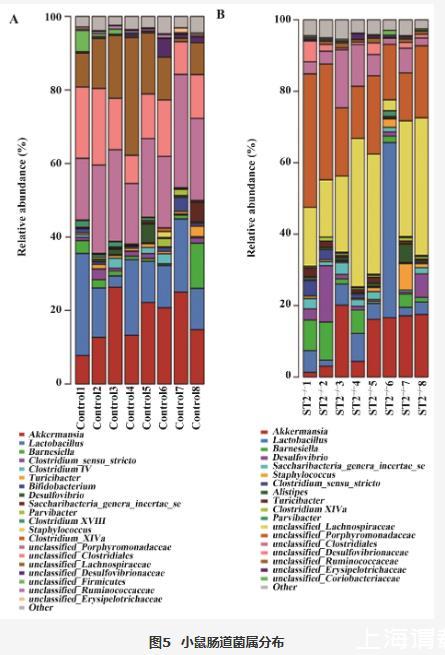
图5 小鼠肠道菌属分布
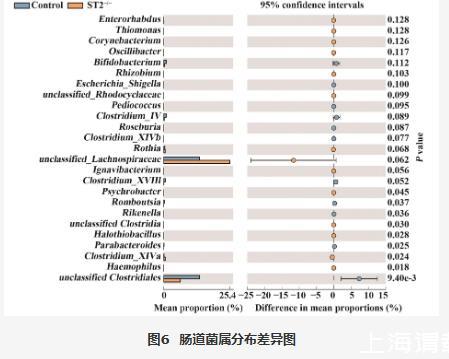
图6 肠道菌属分布差异图
相关新闻推荐
2、牛支原体分离株YJ-22的分离鉴定、生长特性、致病性及免疫原性研究(四)
