1.2方法
1.2.1引物设计及合成
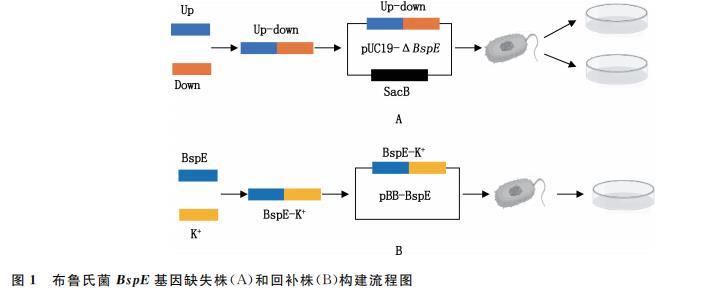
运用同源重组和质粒回补的方法构建布鲁氏菌BspE基因缺失株和回补株。在NCBI搜索牛种布鲁氏菌A19株的第一条染色体的全基因组序列(GenBank登录号:NZ_CP030751.1),使用Snapgene软件设计BspE基因上、下游同源臂引物、缺失株鉴定引物、包含启动子区域的BspE上游引物及携带flag和去掉终止子的下游引物。引物信息见表1,引物均由擎科生物科技公司合成。

1.2.2布鲁氏菌BspE基因缺失株和回补株构建
通过同源重组方法结合电转化法构建布鲁氏菌BspE基因缺失株(图1A),通过质粒回补方法结合电转化法构建布鲁氏菌BspE基因回补株(图1B)。
1.2.3目的基因PCR扩增
利用引物BspE-up-F/R、BspE-down-F/R,以灭活的牛种布鲁氏菌A19菌液为模板,对BspE基因上、下游同源臂进行扩增;利用引物BspE-F/R、Kana-F/R及pBB-F/R,以灭活的牛种布鲁氏菌A19菌液、pET-28a(+)和pBBR1MCS质粒为模板,分别扩增BspE、kana基因片段及pBB复制子片段。PCR反应体系25μL:牛种布鲁氏菌A19菌液3μL,上、下游引物(10μmol/L)各1μL,Primer Star Max Premix 12.5μL,ddH₂O 7.5μL。PCR反应程序:98℃预变性10min;98℃变性10s,60℃退火30s,72℃延伸1min,共30个循环;72℃延伸10min;4℃保存。反应完成后胶回收DNA片段,于-20℃保存备用。
1.2.4融合PCR扩增
将BspE基因上、下游同源臂片段按照1:1比例混合后作为模板,利用引物BspE-up-F、BspE-down-R,通过融合PCR技术进行扩增;将BspE和kana基因片段按照1:1比例混合后作为模板,利用引物BspE-F、Kana-R,通过融合PCR技术进行扩增。PCR反应体系和程序按1.2.3进行。反应完成后对DNA片段进行胶回收,于-20℃保存备用。
1.2.5重组质粒构建及鉴定
使用ClonExpress一步法,分别将融合的BspE基因上、下游同源臂片段与pUC19-SacB质粒、融合后的BspE和kana基因片段与pBB复制子片段进行反应,构建重组质粒pUC19-△BspE和pBB-BspE。反应体系20μL:融合DNA片段8μL,pUC19-SacB/pBB-BspE 2μL,2×ClonExpress Mix 10μL。将反应体系在50℃水浴锅中孵育45min后进行转化,筛选阳性菌落。分别以BspE-up-F、BspE-down-R和BspE-F、Kana-R为引物进行菌液PCR检测,阳性菌液送擎科生物科技公司进行测序鉴定。
1.2.6布鲁氏菌效应蛋白BspE基因缺失株和回补株的构建及筛选
将质粒pUC19-△BspE电转至牛种布鲁氏菌A19感受态细胞,经卡那抗性和蔗糖压力筛选后进行菌液PCR鉴定,筛选BspE基因缺失株A19△BspE。将提取的pBB-BspE质粒电转至A19△BspE株中,经卡那抗性筛选后进行Western blotting鉴定,筛选BspE基因回补株A19C△BspE。
1.2.7布鲁氏菌生长特性分析
将牛种布鲁氏菌A19和鉴定正确的A19△BspE和A19C△BspE进行平板划线,置于37℃恒温培养箱中培养72h,挑取单个菌落接种于15mL TSB培养液中,37℃、180r/min恒温摇床培养至对数生长期。再次分别将牛种布鲁氏菌A19、A19△BspE和A19C△BspE按照1:100比例接种于含100mL TSB培养液的锥形瓶中,37℃、180r/min恒温摇床培养,每隔8h取1mL菌液通过微生物生长曲线分析仪检测菌液D600mm值,直至72h。
1.2.8胞内增殖试验
为检测BspE基因对布鲁氏菌胞内生存的影响,按照5×10⁵/mL将RAW264.7细胞接种于24孔板中,培养12h后,将计数的牛种布鲁氏菌A19、A19△BspE与A19C△BspE按感染复数(MOI)为1:200侵染细胞,置于37℃、5%CO₂培养4h。用PBS洗3次,加入含50μg/mL庆大霉素的培养液,在37℃、5%CO₂培养箱中杀菌1h。用PBS洗3次,加入含25μg/mL庆大霉素的培养液,在37℃、5%CO₂培养箱中培养。在0、6、12、24和48h后弃培养液,用PBS洗3次,加入0.5%Triton X-100,在37℃、5%CO₂培养箱裂解细胞10min以释放细菌,通过10倍梯度稀释涂布于TSA平板上进行菌落计数。
1.2.9细菌黏附试验
细胞接种、攻菌方法同1.2.8,MOI为100。攻菌后在37℃、5%CO₂孵育1h,用无菌PBS清洗3次,加0.5%Triton X-100裂解细胞,进行10倍梯度稀释涂板计数。
1.2.10细菌入侵试验
细胞接种、攻菌、杀菌及维持培养同1.2.8。用含25μg/mL庆大霉素的培养液培养1h后,加0.5%Triton X-100裂解细胞,进行10倍梯度稀释涂板计数。
1.2.11间接免疫荧光试验
为检测效应蛋白BspE在小鼠RAW264.7细胞中的分布情况,将RAW264.7细胞按2×10⁵/mL接种于带有细胞爬片的24孔板中,攻菌、杀菌及维持培养方法同1.2.8,将未感染菌的细胞作为空白对照。感染24h后,用PBS洗3次,加4%多聚甲醛固定液,静置30min,用PBS洗3次,5min/次;加0.5%Triton X-100,室温下静置20min,使细胞穿孔,用PBS洗3次,5 min/次;加入3%BSA封闭液,37℃孵育30 min;弃掉封闭液,直接加入1:100稀释的鼠抗布鲁氏菌血清和兔抗flag抗体,4℃过夜孵育,次日在37℃复温15min,用PBS洗3次,5min/次;加入驴抗鼠和驴抗兔二抗,37℃避光孵育1h,用PBS洗3次,5min/次;加1:1000稀释的DAPI,37℃避光孵育10min,用PBS洗3次,5min/次;滴入抗荧光淬灭剂并封片,用激光共聚焦显微镜观察。
1.3数据统计分析
每组试验重复3次,试验结果以平均值±标准差表示。使用GraphPad Prism9.0软件对数据进行统计学处理,并以t检验进行差异显著性分析。P<0.05表示差异显著。
相关新闻推荐
1、捕食线虫性真菌少孢节丛孢菌不同分离株在4种培养基的生长速度研究(一)
