摘要[目的]检测慢病毒对普通山羊、克隆奶山羊和转基因克隆奶山羊的作用。[方法]采用慢病毒作为载体感染普通山羊、克隆奶山羊(♂12001)和转基因克隆奶山羊(♀12003)体细胞,通过细胞生长曲线,检测慢病毒对3种山羊细胞的毒性作用。[结果]感染后的3种体细胞在感染前3 d,细胞大量凋亡,4~7 d筛选出的细胞大量增殖。未经慢病毒感染的3种细胞接种2 d后数量开始明显增加,第2~5天进入对数生长期,第5~7天进入平台期,呈现典型的“潜伏期-对数生长期-停滞期”生长模式。[结论]慢病毒对细胞有毒性作用,会引起细胞大量凋亡。
目前,常用的病毒载体主要包括腺病毒、逆转录病毒和慢病毒3类。腺病毒具有宿主范围广、致病性低、不会整合到宿主基因组等优点,但是转染效率低。逆转录病毒的转染效率比腺病毒高,但是只能转染分裂期的细胞。慢病毒是逆转录病毒的一种,不但可以转染分裂期的细胞,还可以转染非分裂期的细胞,大大提高了转染效率,但是不论是逆转录病毒还是慢病毒都面临着一个问题:宿主细胞毒性。
诱导性多能干细胞(Induced Pluripotent Stem Cells,iPSCs)是由分化的体细胞通过转入特定基因诱导体细胞重编程成为多能干细胞,避免了胚胎干细胞面临的伦理困境和免疫排斥等问题,给干细胞研究领域带来革命性的变化。在试验过程中,为了获得高转染效率,很多试验人员选择慢病毒载体,但是慢病毒对宿主细胞的毒害作用鲜有报道。细胞生长曲线是测定细胞绝对增长数值的常用方法,也是检测细胞活力的重要指标。因此,取地方品种山羊、克隆奶山羊和转基因克隆奶山羊未感染的第3代处于对数生长期的细胞及对应的病毒感染后的细胞,以培养时间为横坐标,细胞密度为纵坐标绘制生长曲线,从而检测体细胞重编程过程中慢病毒对细胞的作用。
1材料与方法
1.1主要试剂
DMEM培养基、DMEM/F12培养基、胎牛血清(FBS)、非必需氨基酸、双抗、无钙镁PBS缓冲液、胰蛋白酶、谷氨酰胺、β-巯基乙醇均购置于美国Life公司。
1.2方法
1.2.1质粒的转化。将TOP10感受态细胞从-80℃冰箱取出,在冰上融化。将5μL高浓度GOF-18质粒加入感受态细胞中,轻晃混匀,冰上放置30 min。42℃热休克90 s,不要摇动试管。快速转移至冰浴中,冷却2 min。加500μL无抗生素的普通LB培养基,37℃,150 r/min复苏45 min。用无菌接种棒将200μL菌液铺于含抗生素的平板上,37℃正置20 min。倒置平板,37℃培养12~16 h,4℃保存。
1.2.2质粒小量制备提取(试剂盒抽提法)。按Omega质粒小提试剂盒操作手册抽提质粒,步骤如下:取菌液5~10 mL,室温12 000 r/min离心2 min,弃上清。加入250μL Buffer S1,涡旋。加入250μL Buffer S2,上下翻转5~7次。加入350μL Buffer S3,上下翻转数次,室温静置2 min。12 000 r/min,离心10 min。吸取700μL上清液到吸附柱中,11 000 r/min,离心1 min。加500μL Buffer HD,离心同上。加700μL Wash Buffer,离心同上。重复上面的步骤一次。倒去上清液,空离1次,12 500 r/min,离心3 min。取出柱子,放到无菌1.5 mL离心管中,向柱子中央加入65℃预热的Eluent Buffer 80μL,室温静置2 min,12 500 r/min,离心2 min。用紫外分光光度计测定质粒的浓度和纯度。
1.2.3細胞复苏、传代和冻存。将冻存细胞从液氮罐里取出,投入到37℃恒温水浴锅中,迅速解冻,接种到培养瓶中。当细胞汇合到80%以上,用胰酶进行消化传代,多余的细胞加冻存液放到冻存管里,依次放到4℃冰箱里30 min,-20℃冰箱1~2 h,-80℃冰箱过夜,最后放到液氮里长期保存。山羊成纤维细胞使用F3代细胞,293FT细胞解冻后,传代2~3次,调整好细胞状态进行病毒包装。
1.2.4慢病毒包装。将293FT细胞传至T75的培养瓶中,细胞贴壁后换为无抗生素培养基培养至细胞汇合度达80%~90%。准备5个10 mL离心管,前4个加1.5 mL OPTI-MEM,最后一个加6 mL,依次编号①、②、③、④、⑤。将脂质体LIPFACTIN 2000轻轻摇一摇,⑤号管中先吸出260μL OPTI-MEM,再加260μL(65ULX4)脂质体,上下倒置混匀。向①、②、③、④号管中加包装载体PAPX:8μg,PMD:4μg,并且分别加4种因子12μg,用手指轻叩管底,混匀,室温放置5 min。将离心管⑤号管中的溶液分别向①、②、③、④号管各加1.5 mL,用手指轻叩管底,记时20 min到4 h。293FT细胞每个瓶子上标号,①、②、③、④号离心管补加到10 mL,将293FT细胞中的培养液吸出,换成4个离心管中的溶液。8~11 h后换成体细胞培养液。转染后48 h和72 h分别收集病毒,然后用0.45μm滤器过滤后,超低温离心机4 000 r/min,4℃,离心30 min,进行病毒浓缩,分装后冻于-80℃冰箱。
1.2.5包装病毒质量的检测。在24孔板的9个孔中铺293FT细胞,编号①、②、③、④、⑤、⑥、⑦、⑧、⑨。当细胞密度达70%~80%的汇合度时,每个孔加0.5 mL培养液,在①、②、③、④孔中分别加适量的4种病毒浓缩液:OCT4、SOX2、KLF4和CMYC,在⑤、⑥、⑦、⑧孔中分别加适量的4种病毒原液:OCT4、SOX2、KLF4和CMYC,第⑨个孔什么都不加。40 h后在荧光显微镜下观察荧光表达。
1.2.6细胞生长曲线绘制。用胰酶消化羊耳成纤维细胞,用含有病毒感染液的培养液将细胞吹成单细胞悬液,接种到培养板上。取地方品种山羊、克隆奶山羊和转基因克隆奶山羊未感染的第3代处于对数生长期的细胞和对应的病毒感染后的细胞,接种于24孔培养板中,按1×104个/mL的密度,每孔接种1 mL。接种时记为0小时,每隔24 h对3孔内的细胞密度进行计数,计算平均值,一共计数7 d。以培养时间为横坐标,细胞密度为纵坐标绘制生长曲线。
2结果与分析
2.1病毒质量检测
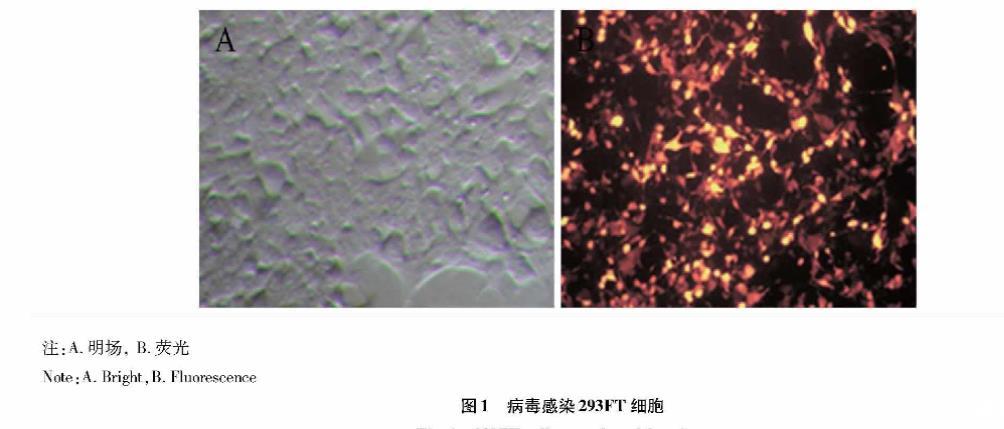
病毒感染40 h后,在荧光显微镜下可以观察到293FT细胞带有红色荧光(图1),说明包装的病毒质量很好,而且浓缩病毒感染后的293FT细胞的荧光强度要强于病毒原液感染后293FT细胞的荧光强度。
2.2诱导前后细胞变化特征
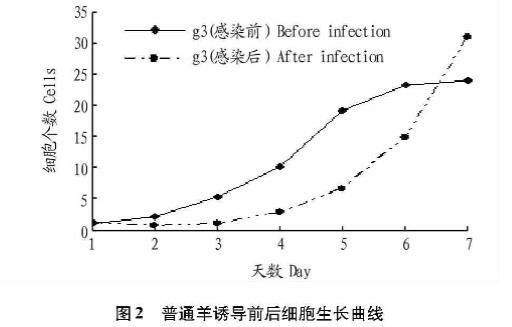
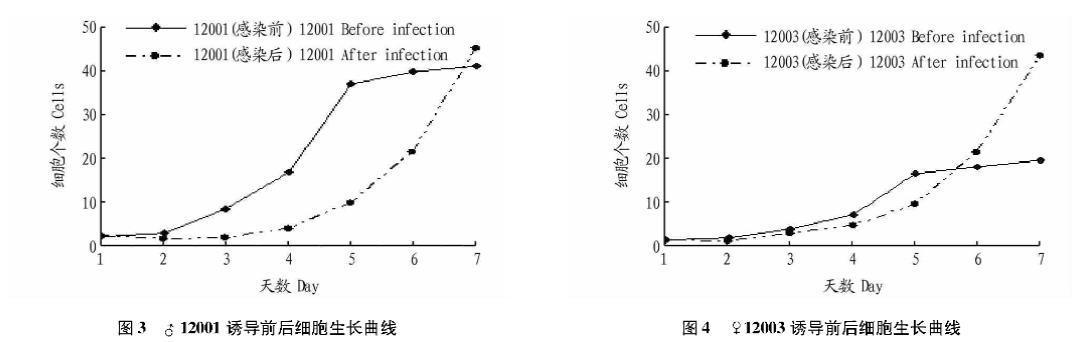
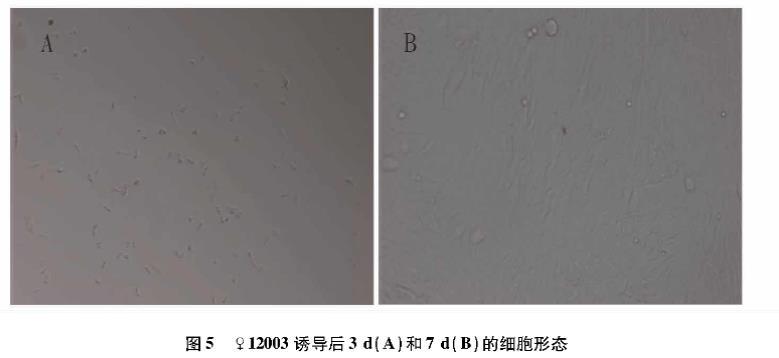
3种细胞接种2 d后数量明显增加,第2~5天进入对数生长期,第5~7天进入平台期,呈现典型的“潜伏期-对数生长期-停滞期”生长模式(图2、3、4)。而感染后的3种体细胞在感染前3 d,细胞大量凋亡(图5A)。4~7 d筛选出的细胞大量增殖(图5B)。
3结论与讨论
实验室已经成功地批量生产转基因克隆奶山羊,通过检测发现,转基因hLF已经很好地整合到这些克隆羊的基因组中。取地方品种山羊、克隆奶山羊和转基因克隆奶山羊未感染的第3代处于对数生长期的细胞及对应的病毒感染后的细胞,以培养时间为横坐标,细胞密度为纵坐标绘制生长曲线。3种细胞接种2 d后数量开始明显增加,第2~5天进入对数生长期,第5~7天进入平台期,呈现典型的“潜伏期-对数生长期-停滞期”生长模式。而感染后的3种体细胞在感染前3 d,由于病毒的侵染,引起了细胞免疫应答,相关基因的表达,外源dsRNA和多肽引起细胞凋亡,氧化还原,DNA重置和抗原反应。由于病毒侵入引起的这些突出的
生物学过程还伴随着细胞凋亡,0~4 d细胞增殖速度加快,但是伴随有大量的诱导凋亡的过程。这个时间段的作用可能是使外源转录因子融入细胞,并筛选更加强壮的病毒感染后的细胞,4~7 d筛选出的细胞大量增殖。
