2结果
课题组前期在实验室菌株和工业衍生菌株表达纤维素酶及利用木质纤维素料发酵产醇方面做了很多工作,既观察到了不同菌株在发酵性能和异源蛋白表达水平上的巨大差异,也发现了不同来源β-葡萄糖苷酶表达所致明显不同的代谢负担。这里以W303-1A和An-a菌株作为出发菌株来构建UPR响应指示菌株,并进一步表达β-葡萄糖苷酶。选择26bp UPRE和CYC1基因起始密码子上游250bp序列组合的杂合启动子控制下的β-半乳糖苷酶Lac Z编码基因为报告基因(简写为UPRE-lac Z),利用基于CRISPR-Cas9系统的基因操作技术,构建得到W303-1A(leu 2∷UPRE-lac Z)和An-a(leu 2∷UPRE-lac Z);为方便叙述,菌株分别简称为WZ和AZ。26bp UPRE实际为KAR2基因的上游激活序列(upstream activating sequence,简称UAS);其中的22bp序列5'-GGAAC TGGACAGCGTGTCG AAA-3'是UPRE中的核心序列,为数百个UPR靶基因共同拥有,在激活UPR的条件下,这些基因由此序列介导而被诱导激活。而250bp序列里不含有UAS,在没有UAS序列启动激活的情况下,其导致的基因基础表达水平很低,且低于由KAR2相应序列所导致的基因基础表达水平。这也是本研究选择此杂合启动子来调控Lac Z表达的原因。
2.1 WZ和AZ构建
指示菌株构建分如下三大步骤进行。
2.1.1 gRNA表达载体pRS42H-gLEU2构建UPRE-lac Z片段的整合位点选择在LEU2基因内,相应地,根据guide RNA设计原则,靶向LEU2基因位点、供guide RNA合成的DNA序列设计为5'TATTTACTTTGGTAAGAGAA 3'(参见表2中的引物对P1和P2),其对应于LEU2基因ORF的第423~442位碱基序列,亦即GenBank中序列号为NC_001135.5中的第91 324~92 418碱基序列。
首先以Not I酶切线型化的pRS42H-gRNA质粒片段为模板,使用引物对P1和P2进行反向PCR,扩增得到6 528bp的PCR片段(见琼脂糖凝胶电泳图1a);然后连接、转化和鉴定。即对LB+Amp100筛选平板上生长的菌落进行液体培养后提取质粒,Not I酶切鉴定和测序。结果证明转化子质粒提取物中Not I酶位点被替换为前述20 bp靶向碱基序列,pRS42H-gLEU2质粒构建成功。
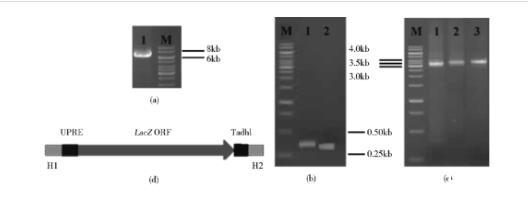
图1 PCR片段琼脂糖凝胶电泳图谱和供体DNA片段示意图
2.1.2含UPRE-lacZ基因表达盒的供体DNA片段制备分别以酵母菌株WC、大肠杆菌菌株DH5α和酵母菌株WC的基因组DNA为模板,使用表2所示三对引物对P3/P4、P5/P6、P7/P8进行三个片段的扩增:含元件H1+UPRE的PCR1片段(364bp),其中H1对应LEU2基因ORF内第371~442位共72bp序列;含元件lacZ ORF的PCR3片段(3 095bp);含元件TadhI+H2的PCR2片段(302bp),其中H2对应LEU2基因ORF内第446~515位共70bp序列。再分别以PCR1和PCR3为模板,使用引物对P3、P6进行第一轮重叠交叉延伸PCR反应,产物命名为PCR13,预期长度3 439bp;以PCR13和PCR2为模板,使用引物对P3、P8进行第二轮重叠交叉延伸PCR反应,产物命名为PCR123,预期长度3 721bp。由图1b-1d可知五个片段均具有预期大小;3 721bp PCR产物为供体片段。
2.1.3 W303-1A(leu2∷UPRE-lacZ)和An-a(leu 2∷UPRE-lacZ)构建首先将Cas9表达质粒YCplac33-Cas9转化菌株W303-1A和An-a感受态细胞,分别得到W303-1A(YCplac33-Cas9)和An-a(YCplac33-Cas9)菌株;制备其感受态细胞,将pRS42H-gLEU2质粒和3 721bp PCR产物分别共转化,涂布CMG-URA+HyB筛选平板,倒置培养;对筛选平板上生长菌落顺次进行CMG-URA+HyB平板复筛、平板显色、菌落PCR鉴定及测序。平板显色结果见图2,平板显色菌落PCR鉴定产物的琼脂糖凝胶电泳图谱见图3;结果证明了转化子显色反应与PCR鉴定结果之间的高度一致。PCR鉴定用引物对为表2中的P9、P10,阳性菌株和阴性菌株预期PCR片段分别为4 327bp和795bp。

图2平板菌落显色(左W303-1A宿主,右An-a宿主)
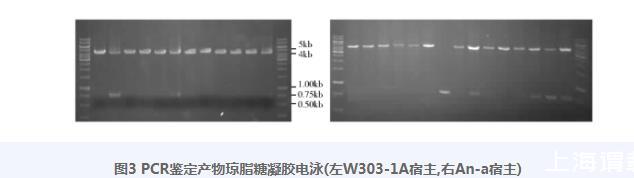
图3 PCR鉴定产物琼脂糖凝胶电泳(左W303-1A宿主,右An-a宿主)
分别选择显色典型的菌株55#和58#进一步进行测序,测序结果证明没有突变。为叙述方便,以下将这两个指示菌株分别简称为WZ和AZ。
2.2 WZ和AZ生长曲线测定
为检查表达UPRE-lacZ基因和CRISPR/Cas9基因编辑技术本身可能导致的生长缺陷,首先将指示菌株及其亲本菌株一起进行了生长对比评价,结果见图4。图4显示:WZ和W303-1A之间生长彼此接近;而AZ和An-a相比之下则表现出了轻微的生长抑制,推测可能与lacZ的基础表达有关。
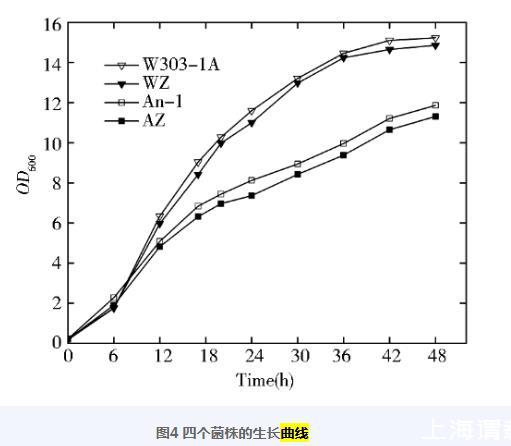
图4四个菌株的生长曲线
2.3 WZ和AZ对乙酸和乙醇UPR响应评价
如前言所述,木质纤维素原料发酵产醇体系中的乙酸、甲酸、糠醛和乙醇等组分都会抑制酵母细胞活性、影响发酵性能。这里先考察指示菌株对乙酸和乙醇的反应,并附上了衣霉素作为对照。衣霉素是强的UPR诱导剂,通过抑制蛋白质的N-糖基化使蛋白质发生错误折叠,引起ER中蛋白质的大量积累,从而激活UPR途径。
先预实验考察了衣霉素、乙醇、乙酸三种试剂不同浓度对菌株WZ和AZ生长抑制效应,据之设计了菌株对数期的添加浓度;添加4h时的结果见图5,图中A代表菌株AZ,W代表菌株WZ。比值为各处理样品对没有添加任何试剂的对照样品即A-1和W-1的OD600值或LacZ酶活值的比值。
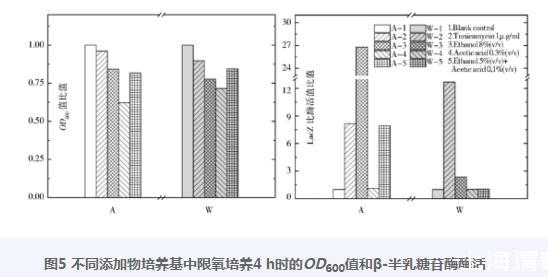
图5不同添加物培养基中限氧培养4 h时的OD600值和β-半乳糖苷酶酶活
很明显,三种试剂对菌株AZ和WZ的生长都有抑制效应,以添加乙酸至终浓度0.3%(v/v)的抑制最强,OD600值分别为对照OD600值的62.0%和72.0%。而LacZ酶活值的高低则与生长抑制程度无关:AZ对乙醇的响应相对最强,为对照本底值的26.4倍,对衣霉素响应则与(乙醇+乙酸)相当;而WZ对衣霉素的响应值为对照本底值的12.6倍。实验结果清楚地显示了两个菌株在UPR信号响应谱上的显著差异。
2.4 WZ和AZ对β-葡萄糖苷酶表达的UPR响应评价
质粒BG(见表1)为高拷贝数β-葡萄糖苷酶表达载体,导入酵母菌株后β-葡萄糖苷酶的表达使得细胞具有利用纤维二糖生长和发酵的能力;在以纤维二糖为唯一碳源的培养基里,在一定范围内,菌株的生长情况与细胞表达β-葡萄糖苷酶的水平呈正相关。两个菌株在YPC液体培养基里生长24h后的酶活值见图6。菌株WZ(BG)菌液β-葡萄糖苷酶酶活值为菌株AZ(BG)菌液相应酶活值的17.5倍,但它们的Lac Z酶活仅为各自对照本底值的5.4倍和3.1倍,暗示了菌株WZ对异源蛋白表达有较菌株AZ更高的ER加工容量和UPR调控容量。
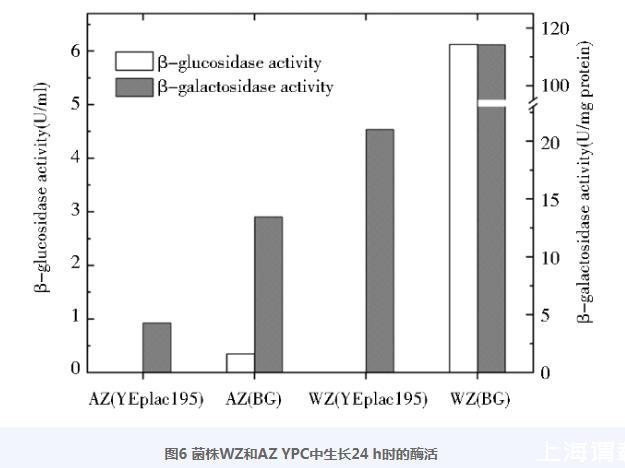
图6菌株WZ和AZ YPC中生长24 h时的酶活
相关新闻推荐
2、阐明脓毒症中肠道微生物群和代谢物的组成及其与疾病进展的关系(一)
3、菌龄、碳、氮源对产D-氨基酰化酶的菌株A55生长及酶活力的影响
