1.3.2氨氮降解菌的分离纯化
配制好分离平板培养基,灭菌、分装、冷却后,取第2次富集培养基中的上清菌液1 mL,在无菌操作条件下将培养液稀释、涂布于分离平板培养基上,于28℃恒温培养箱培养2~3天,至平板长出单菌落为止;挑取各个单菌落至新的平板上划线,28℃下培养2~3天,至平板上长出单菌落为止,以进一步纯化;挑选各个单菌落于斜面培养基上,于28℃下培养24 h;待斜面长出菌苔后,分别以斜面固态保藏于4℃冰箱和中制成甘油管保藏于-20℃冰箱中。
1.3.3制备菌悬液及测定细胞浓度
将活化后的各菌种接入摇瓶种子培养基;各接入1环,于150 r/min、28℃恒温摇床培养24 h;在4℃、10000 r/min下离心15 min并弃上清液,收集菌体;将湿菌体加至无菌的生理盐水中洗涤3~4次,测定OD600=1,并将其配制成细胞浓度约为109个/mL的菌悬液备用。
1.3.4筛选高效降解菌
制备摇瓶筛选培养基190 mL加入1000 mL的三角瓶中,灭菌、冷却后,分别接入各菌株的细胞浓度相等的菌悬液;置于150 r/min、28℃恒温摇床中培养72 h;采用《水杨酸分光光度法》分析经各菌种降解后的培养基中的氨氮残留量(24,48,72 h各测1次);用未接种的摇瓶做参照,记录数据并计算氨氮降解率,并按式(1)计算菌株的氨氮降解率:

综合数据,根据降解率的大小,优选出降解效率最高的目的菌株。
1.3.5高效降解菌菌株最大吸收波长的测定
配制好100 mL活化培养基,灭菌、冷却后,将优选出的菌株在活化培养基中活化24 h(将斜面保藏的菌种接1环到活化培养基中,置于28℃和150 r/min条件下培养24 h),取培养液用紫外-可见光分光光度仪在340~600 nm的波长下以未接种的培养基为参比测定其OD值,以波长为横坐标,以OD值为纵坐标画图,确定该优选菌株的最大吸收波长。
1.3.6高效降解菌菌株的生长曲线测定
将活化好的优选菌株,接1环至新鲜的活化培养基,在28℃、150 r/min恒温振荡培养,在该优选菌株的最大吸收波长处,每隔2 h取一定量培养液测定其OD值,以培养时间为横坐标,以最大吸收波长处的OD值为纵坐标绘制生长曲线。
1.3.7氨氮降解菌菌株的初步鉴定
对优选菌种进行平板培养、革兰氏染色,观察其菌落形态及革兰氏属性。同时,参照《伯杰氏细菌鉴定手册》的方法,对生理生化特征等方面进行初步鉴定,如葡萄糖发酵试验、需氧性试验等。
1.3.8菌株的16S rDNA测序
氨氮降解菌菌株的16S rDNA PCR扩增引物采用通用引物:正向引物27F为5′-AGAGTTTGATCC-TGGCTCA-3′,反向引物1492R为5′-GGTTACCTTG-TTACGACTT-3′(由上海生物工程有限公司合成),扩增产物电泳检测后送上海生物工程有限公司测序,将测得序列通过NCBI(http://www.ncbi.nlm.nih.gov)网站的GenBank核酸序列数据库内进行BLAST比对,找出核酸数据库中与氨氮降解菌菌株同源性较高的菌株序列,下载这些菌株的DNA序列,然后用生物软件MEGA4进行CLUSTAL比对并构建氨氮降解菌菌株的系统发育树。
2实验结果
2.1分离筛选高效氨氮降解菌的结果
富集实验的情况如下:第1天富集后pH为6.10;第2天为4.5,说明富集的菌株是产酸的;分离纯化试验:从泡菜原材料中共筛选了25株能降解高浓度氨氮的菌株;最后对这25株菌进行了氨氮降解率的测定实验。结果表明:在氨氮浓度为500 mg/L的液体培养基下,24 h内这些菌株氨氮降解率的范围为3.85%~29.81%;48 h的氨氮降解率范围为13.46%~43.64%,72 h的氨氮降解范围为35.72%~64.85%。由于硫酸铵在培养基灭菌过程中会出现高温分解,从而导致NH4-N的浓度降低,因此在培养基的配制过程中采用先不加硫酸铵灭菌后,通过过滤除菌将硫酸铵加入到培养基中后接种培养。试验表明:LJK8菌株的降解率最高为64.85%,因此对LJK8菌株做进一步的研究。
2.2 LJK8菌株最大吸收波长的测定
LJK8菌株吸收波长实验结果见图1。
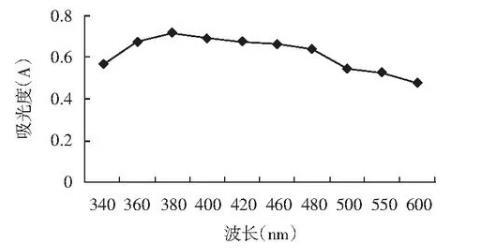
图1 LJK8菌株吸收波长
由图1可知,在波长340~600 nm之间,LJK8菌株在380 nm处有最大吸收峰,由此在380 nm处测其生长曲线,以研究其生长量与氨氮降解率之间的关系。
2.3 LJK8菌株的生长曲线测定
LJK8菌株的生长曲线测定结果见图2。
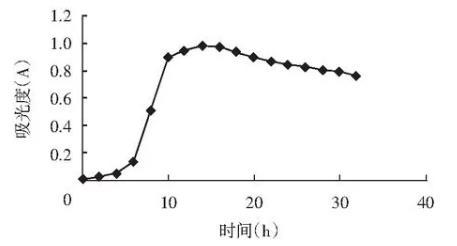
图2 LJK8菌株的生长曲线
由图2可知,LJK8菌株在0~6 h为生长的适应期;在6~14 h为对数生长期;在14~36 h为生长的稳定期;在36 h之后才有所衰亡。LJK8菌株达到最大生长量是在培养第20 h。
