摘要
木质纤维素生物质在单一反应器中进行水解和发酵的新型加工策略,为生物商品和生物燃料的生产提供了巨大的潜在成本节约。一个关键挑战是在高产物浓度下保持高酶产量。为实现此目标,我们对纤维素分解、产乙醇的细菌Clostridium phytofermentans进行了适应高乙醇浓度的驯化。获得的乙醇耐受性(ET)菌株的乙醇耐受性几乎比野生型提高了一倍,但在低乙醇浓度下乙醇产量和生长速率均有所降低。ET菌株的基因组在涉及膜生物合成、Rnf复合物、阳离子稳态、基因调控和乙醇生产的蛋白质中发生了编码变化。特别地,对突变型双功能乙醛辅酶A(CoA)/醇脱氢酶的纯化表明,G609D变体使其活性(包括乙醇形成)丧失。在ET菌株中异源表达Zymomonas mobilis的丙酮酸脱羧酶和醇脱氢酶,增加了纤维素消耗并恢复了乙醇产量,证明了如何利用代谢工程来克服在乙醇适应过程中产生的不利突变。我们讨论了ET菌株的遗传变化如何揭示了提高微生物溶剂耐受性的新的潜在策略。
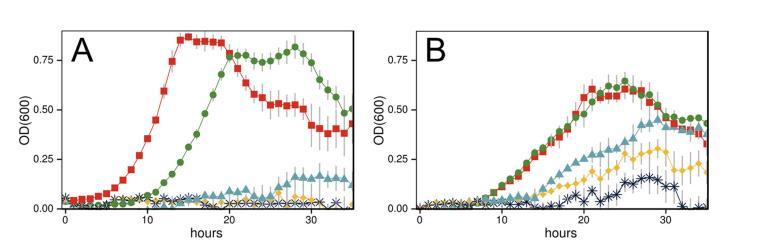
木质纤维素生物质转化为燃料和商品是大规模、可再生的石油替代方案。这种多步生物转化传统上在一系列独立的工艺中进行,但整合生物加工(CBP)是一种具有潜在经济优势的替代范式(1)。在CBP中,酶生产、水解和发酵在单个反应器中发生,从而节省资本和运营成本,并产生协同效应(2)。我们研究了Clostridium phytofermentans,一种有前景的CBP候选菌,它能将植物生物质主要发酵为乙醇(3, 4)。C. phytofermentans水解预处理过的玉米秸秆(包括葡聚糖和木聚糖)的效率,与使用商业酶和木糖发酵酵母(Saccharomyces cerevisiae)的同时糖化共发酵(SSCF)相似(5)。C. phytofermentans发酵预处理过的玉米秸秆可达到7 g liter-1的乙醇浓度(6),而C. phytofermentans和S. cerevisiae cdt-1的稳定共培养物可将约70 g liter-1的纤维素发酵为22 g liter-1的乙醇(7),该乙醇浓度会抑制C. phytofermentans的生长。因此,应用C. phytofermentans等CBP细菌可能需要提高其溶剂耐受性,同时不损害酶生产或可溶性碳水化合物发酵为乙醇的能力。
大量努力集中在使梭菌适应更高的溶剂水平,并研究与溶剂适应相关的遗传和生理变化(8-13)。其他研究表明,在主要产生乙醇以外发酵产物的梭菌中,乙醇产量得到提高。表达丙酮酸脱羧酶和醇脱氢酶(ADH)的C. celluloyticum克服了丙酮酸积累,并将发酵产物从乳酸转变为乙酸和乙醇(14)。在C. thermocellum中,通过丙酮酸激酶(15)重定向碳流、失活乳酸脱氢酶和磷酸转乙酰酶(16)以及删除氢化酶(17)均能改善乙醇生产。这些结果表明,尽管基因工具现在才被开发出来,但在纤维素分解梭菌中工程化改进乙醇生产是可能的。然而,开发既耐受乙醇又能高产乙醇的菌株仍然是一个重大挑战。
本文中,我们试图通过连续传代到递增的乙醇浓度中,开发一株具有提高乙醇耐受性的C. phytofermentans菌株,并表征其生长和发酵特性。我们对ET菌株基因组进行了测序,以揭示适应过程中出现的基因组突变,并通过异源表达替代乙醇形成途径来克服ET菌株乙醇产量降低的问题。我们讨论了本研究的结果如何增进我们对微生物如何适应乙醇等溶剂高浓度的理解。
材料与方法
培养。C. phytofermentans ISDg (ATCC 700394) 在Coy厌氧工作站中,在1.5% H2/98.5% N2气氛下进行厌氧培养。培养物在30°C、pH调整为7的GS2培养基(18)中静置培养,并如文中所述补充碳源。生长动力学通过密封的100孔微孔板(Bioscreen 9502550)中的600 nm光密度(OD600)监测,如前所述(19);每次光密度测量前,对培养物进行短暂摇晃以重悬细胞。用于底物消耗和发酵产物分析的纤维素、纤维二糖和葡萄糖培养物在100-ml血清瓶中生长,脱气后用丁基橡胶塞密封。

C. phytofermentans乙醇耐受性(ET)菌株通过连续传代(1:50稀释)到含有10 ml补充了递增乙醇浓度的GS2培养基的培养管中进行筛选。从在4%(体积/体积)(31.5 g liter-1)乙醇中的培养物开始,每周传代到含有相同乙醇浓度和乙醇浓度高1%的新鲜培养基中。如果在较高浓度下1周后未观察到生长,则培养物重新传代到相同的乙醇浓度。如果培养物在较高乙醇浓度下生长,则该培养物再次传代到该乙醇浓度和高1%的乙醇浓度。在7次每周传代后观察到在5%乙醇中生长,13次传代后在6%乙醇中生长,19次传代后在7%乙醇中生长。每次乙醇耐受性提高时,将细胞铺板,挑取单个菌落,并重新接种液体培养物,以确保选择是基于一株具有提高的乙醇耐受性的特定菌株,而不是基于一个共同在提高的乙醇浓度下存活的菌株联盟。因此,ET菌株是从在补充了7%(体积/体积)乙醇的GS2培养基中生长的母培养物中通过菌落纯化分离得到的。经菌落纯化后,确认ET菌株具有与母培养物相似的乙醇抗性。
纤维素和发酵分析。培养物中剩余的纤维素水平通过用无菌注射器从10-ml培养管中取1-ml样品,放入预称重的1.7-ml微量离心管中,在13,000 x g离心10分钟进行测量。去除上清液,纤维素沉淀被洗涤并再次在13,000 x g离心10分钟。冲洗后的沉淀在70°C下干燥直至恒重。细胞生物量对总纤维素重量的贡献未计入,并假设由于厌氧生物量产量低而最小。
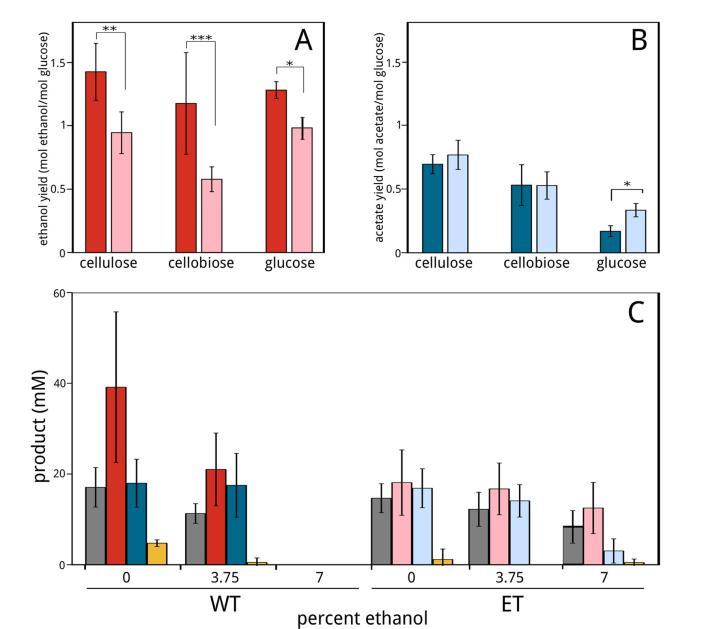
发酵产物浓度在0.22 μm孔径过滤的培养上清液中使用Agilent 1100高效液相色谱(HPLC)与Jasco RI-1531折射率检测器(RID)和Aminex HPX-87H阳离子交换柱(Bio-Rad)进行测量。HPLC运行使用0.01 M硫酸流动相,柱温65°C,RID温度30°C,样品体积25 μl,操作流速0.6 ml/min。产物形成相对于接种时培养基中的浓度进行报告。气相测量通过抽取1 ml顶空并注入100 μl到气相色谱仪(Model 8610C multiple-gas analyzer; SRI Instruments)中进行。氩气作为载气,并调整至30 lb/in2 表压。使用不锈钢分子筛(13x)和硅胶填充柱进行样品分离,组分使用热导检测器(TCD)检测。柱室温度初始保持在40°C 3.5分钟,然后程序升温至160°C 2分钟,再至300°C 10分钟,之后让柱冷却至40°C直至样品运行结束。
相关新闻推荐
1、淀粉芽孢杆菌、枯草芽孢杆菌抑制茄病镰刀菌效果显著,可促进黄瓜幼苗生长(二)
2、牛支原体分离株YJ-22的分离鉴定、生长特性、致病性及免疫原性研究(一)
