摘要
抗生素的广泛使用导致了多种耐药机制,严重挑战了我们治疗细菌感染的能力。在治疗中使用的抗生素浓度较高时,可以选择耐药细菌,但在许多环境中,抗生素浓度低得多的细菌在选择中起到了什么作用仍不清楚。在这里,我们使用高度敏感的竞争实验表明,耐药性细菌的选择发生在极低的抗生素浓度下。因此,对于三种临床上重要的抗生素,药物浓度高达敏感细菌最低抑制浓度几百倍以下,即使在初始分数非常低的情况下,也可能富集耐药细菌。我们还表明,在亚MIC浓度的抗生素中可以选择从头突变株,并且我们提供了一个数学模型,预测这种突变株在易感人群中接管的速度。这些结果为耐药性的演变增加了另一个维度,并表明在许多自然环境中发现的低抗生素浓度对于细菌种群中耐药性的富集和维持非常重要。
作者摘要
由于抗生素在人类和兽医以及农业中的广泛使用和滥用,抗生素耐药性已成为一个非常重要的卫生保健问题。目前尚不清楚大多数耐药细菌是从何处筛选出来的,尤其是在治疗或促进生长的使用过程中,自然环境或人体/动物体内存在的低抗生素浓度是否对耐药突变株的选择和富集很重要。所提供的数据表明,对于几种临床使用的抗生素,极低浓度(与自然环境中发现的浓度相似)可以选择耐药细菌。这些结果表明,抗生素释放到环境中可能是耐药性产生和维持的重要因素,并强调了采取措施减少抗生素污染的重要性。
介绍
抗生素是人类最重要的医学发明之一,但在过去几十年中,抗生素耐药性的持续快速发展已成为社区和医院环境中最严重的卫生保健问题之一[1,2,3]。然而,一些产生耐药性的基因最有可能最初被选择用于代谢功能和/或信号传输或对抗竞争性抗生素产生菌的保护[4],最近在全球范围内,微生物圈中高抗药性致病细菌的富集和传播在很大程度上是由人类活动推动的,包括在人类和兽医以及农业中广泛使用和滥用抗生素[2,3,5,6,7]。虽然在治疗上使用的高浓度抗生素显然可以选择耐药突变株,但由于人为输入污染自然(如水生或土壤)环境的低抗生素浓度有多重要仍不清楚[8,9,10],由产生抗生素的微生物自然产生的,或在治疗或促生长使用期间存在于某些人体/动物体内的,用于选择和富集抗性突变体。在药效学模型中,通常假设仅在易感野生型种群(MICsusc)和耐药菌(MICres)[11,12](突变选择窗假说,见图1A)的最小抑制浓度(MIC)和以下浓度之间的浓度下,才会选择耐药菌MICSUC不会抑制易感细菌的生长,因此不具有选择性。早期关于细菌对抗生素敏感性存在微小差异的选择的研究表明,选择可以有效地根据微小差异进行耐药性选择[13,14,15]。此外,最近的一项研究使用一种优雅的基于颜色的分析定性地表明,MIC以下的抗生素水平可以富集耐药细菌[16]。在此,我们进一步探索突变选择性窗口假设,如图1A所示,我们研究了两种细菌和三种抗生素,由于敏感突变株的生长速度略有下降,它们的选择性富集程度远远低于MICSUC预先存在和从头生成的耐药突变株。
为了确定暴露于极低抗生素浓度(、、MICsusc)是否会导致耐药突变株的富集,我们使用了大肠杆菌和肠道沙门氏菌(鼠伤寒变种LT2)(正文S1中的表S1)的几种定义明确的突变体,以及对人类和兽医具有高度重要性的三种不同类别的抗生素(四环素类、氟喹诺酮类和氨基糖苷类)。使用的耐药标记物是Tn10dTet(赋予四环素耐药性)、gyrA(S83L和D87N)、DmarR和DacrR突变(赋予环丙沙星耐药性)和rpsL(赋予链霉素耐药性),所有这些都在几种不同细菌的临床分离株中发现。利用敏感菌株和耐药菌株的等基因对之间的高度敏感竞争实验,我们表明,在远低于最低抑菌浓度的抗生素浓度下,可以选择耐药细菌。最后,我们提出了一个数学模型,展示了耐药突变体如何在这些抗生素的亚MIC水平下从头出现并在细菌种群中传播。
为了确定暴露于极低抗生素浓度(、、MICsusc)是否会导致耐药突变株的富集,我们使用了大肠杆菌和肠道沙门氏菌(鼠伤寒变种LT2)(正文S1中的表S1)的几种定义明确的突变体,以及对人类和兽医具有高度重要性的三种不同类别的抗生素(四环素类、氟喹诺酮类和氨基糖苷类)。使用的耐药标记物是Tn10dTet(赋予四环素耐药性)、gyrA(S83L和D87N)、DmarR和DacrR突变(赋予环丙沙星耐药性)和rpsL(赋予链霉素耐药性),所有这些都在几种不同细菌的临床分离株中发现。利用敏感菌株和耐药菌株的等基因对之间的高度敏感竞争实验,我们表明,在远低于最低抑菌浓度的抗生素浓度下,可以选择耐药细菌。最后,我们提出了一个数学模型,展示了耐药突变体如何在这些抗生素的亚MIC水平下从头出现并在细菌种群中传播。
结果
在单一培养基中对低抗生素浓度的影响进行了初步检查,其中在不同浓度四环素的存在下分别培养了携带Tn10dTet的易感野生型和耐药突变体。如图1B和文本S1中的表S2所示,远低于MICsusc的浓度降低了敏感菌株的指数增长率,而对抗性菌株没有任何明显影响。例如,在MICsusc浓度为1/30时,易感菌株的生长速度比不使用抗生素的菌株慢约15%,而耐药突变株似乎未受影响,这表明在这些低浓度下,耐药菌株被强烈选择。为了提高这些检测的灵敏度,并允许检测到生长率的极小差异,我们在敏感菌株和耐药菌株之间进行了竞争实验。敏感和耐药突变株的MIC分别为:鼠伤寒沙门氏菌野生型(链霉素=4μg/ml,四环素=1.5μg/ml)、rpsL K42R.1024μg/ml和Tn10dTet菌株=128μg/ml;大肠杆菌野生型(环丙沙星=0.023 ug/ml)、gyrA S83L(环丙沙星=0.38 ug/ml)、gyrA D87N(环丙沙星=0.25 ug/ml)、DacrR(环丙沙星=0.047 ug/ml)和DmarR(环丙沙星=0.047 ug/ml)。这些菌株被绿色荧光蛋白基因的变体(yfp和cfp,分别编码黄色和青色荧光蛋白)基因标记,以便通过荧光激活细胞分选(FACS)对大量竞争细胞进行计数,从而显著减少与小群体计数相关的任何实验误差。除了抗性决定簇和产生相应荧光蛋白的yfp和cfp基因外,竞争菌株均为等基因。对照实验表明,cfp和yfp标记之间的适应成本差异对生长率的影响可以忽略不计(图S1)。在不同浓度的抗生素四环素、环丙沙星(一种氟喹诺酮)和链霉素(一种氨基糖苷)以及不含药物的情况下(图2A-D、图3A-H、图4A-E),通过分批培养连续传代,这些菌株竞争多达80代。正如我们之前的研究[17]所示,这种实验装置允许检测至少小到0.3%的生长率差异,这接近由周期性选择事件干扰设定的灵敏度极限。图1B所示的生长率测量仅测量了生长的指数阶段,而竞争实验代表了生长和存活在滞后阶段、指数阶段和稳定阶段的组合,允许检查整个生长周期。
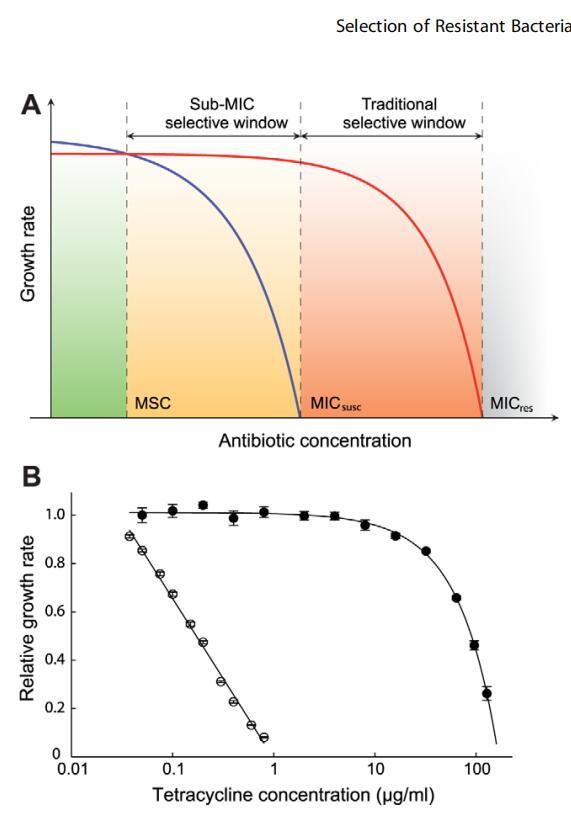
图1。生长率是抗生素浓度的函数。(A)生长率随抗生素浓度变化的示意图。绿色表示易感菌株(蓝线)将超过抗性菌株(红线)的浓度区间。橙色(亚MIC选择窗口)和红色(传统突变选择窗口)表示抗性菌株将超过敏感菌株的浓度区间。MICsusc=敏感菌株的最小抑制浓度,MICres=抗性菌株的最小抑制浓度,MSC=最小选择浓度。(B)。作为四环素浓度的函数,鼠伤寒沙门氏菌敏感(开放循环)和抗性(封闭循环)菌株的相对指数增长率。显示了平均值的标准误差。相对增长率为1.0相当于约1.8 hr21。细胞在37℃的Mueller-Hinton培养基中生长。doi:10.1371/期刊。ppat。1002158.g001
图2A、C、图3A、C、E、G和图4A-D所示的数据显示了耐药菌株与敏感菌株的比率是如何随着不同浓度抗生素下的生长世代数而变化的。每条线代表一个竞争实验,斜率是选择系数(s值)的度量。因此,在没有抗生素的情况下获得的负斜率是抗生素耐药机制适应成本的度量,而正斜率表明耐药突变体得到了富集。当从这些实验中获得的s值绘制为抗生素浓度的函数时,截距s=0,表示我们指定的最小选择浓度(MSC),其中抗性的适应成本通过抗性突变体(图2B、D、图3B、D、F、H和图4E)的抗生素选择来平衡。根据所检测的抗生素和耐药突变类型,MSC在MICSUC的1/4到1/230之间变化。对于链霉素,MSC值为敏感菌株(图2B)MIC值的1/4,对于四环素1/100(图2D)和环丙沙星,其在MICSUC的1/10(图3B)和1/230(图3D)之间变化,取决于特定的抗性突变。这些值对应于1 mg/ml(链霉素)、15 ng/ml(四环素)和2.5 ng/ml至100 pg/ml(环丙沙星)的绝对抗生素浓度。对一小部分抗性突变体进行的竞争也表明,选择系数与抗性突变体的初始频率无关。即使在初始频率低至1024的情况下,也可以观察到抗性突变体以1:1的比例富集(即相同的选择系数)(比较图2D和4E)。
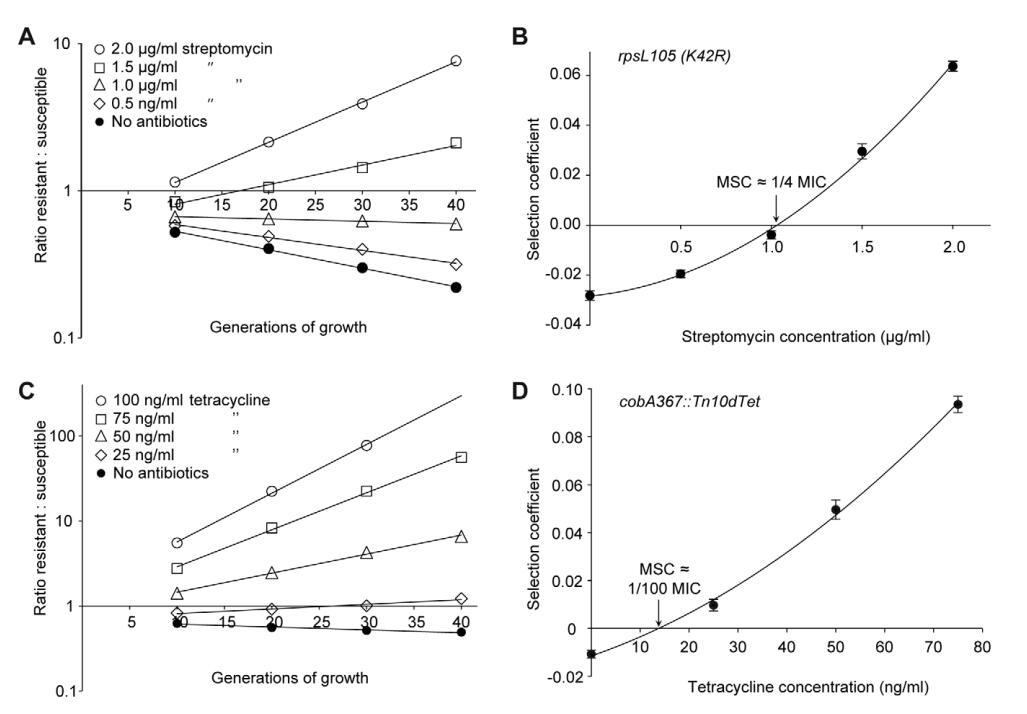
图2。敏感菌株和耐药菌株、链霉素和四环素之间的竞争实验。在不同浓度的抗生素(A(rpsL105(K42R))和C(Tn10dtet)下进行竞争实验,并计算选择系数作为抗生素浓度(B和D)的函数。图A和图C分别基于一次比赛实验(四次比赛的平均值),而图B和图D则根据多达20次比赛的选择系数计算(文本S1中的表S3)。显示了平均值的标准误差。doi:10.1371/期刊。ppat。1002158.g002
由于抗性突变体可以从极低的初始组分(1024)中富集,我们还测试了是否可以从易感群体中从头选择抗性突变体。为此,我们在链霉素MIC的1/4下培养了20个易感野生型鼠伤寒沙门氏菌LT2菌株的独立谱系700代,并通过在不同浓度的链霉素上电镀连续筛选耐药细胞。在这种低水平的抗生素下,我们可以观察到新发耐药突变体的快速富集(图5)。因此,在200至400代内,可以看到大量抗性在起始菌株MIC(8–64 mg/ml)的2至16倍之间的突变体,在500至600代后,也出现了高水平抗性突变体(野生型MIC的24–32倍=96–128 mg/ml)。400代后,所有20个谱系都含有MIC高于32 mg/ml(8倍MIC)的亚群,600代后,14个谱系的MIC高于64 mg/ml(16倍MIC)的亚群。使用上述方法,20个野生型大肠杆菌谱系在亚MIC水平的环丙沙星中生长了600代。在以MIC的1/10生长500代后,其中五个谱系的亚种群(占种群的1%)对环丙沙星具有低水平抗性(MIC比易感亲本菌株高2倍),600代后,每20个谱系中就有一个细胞亚群的MIC比易感亲本菌株高8倍(见图S2)。
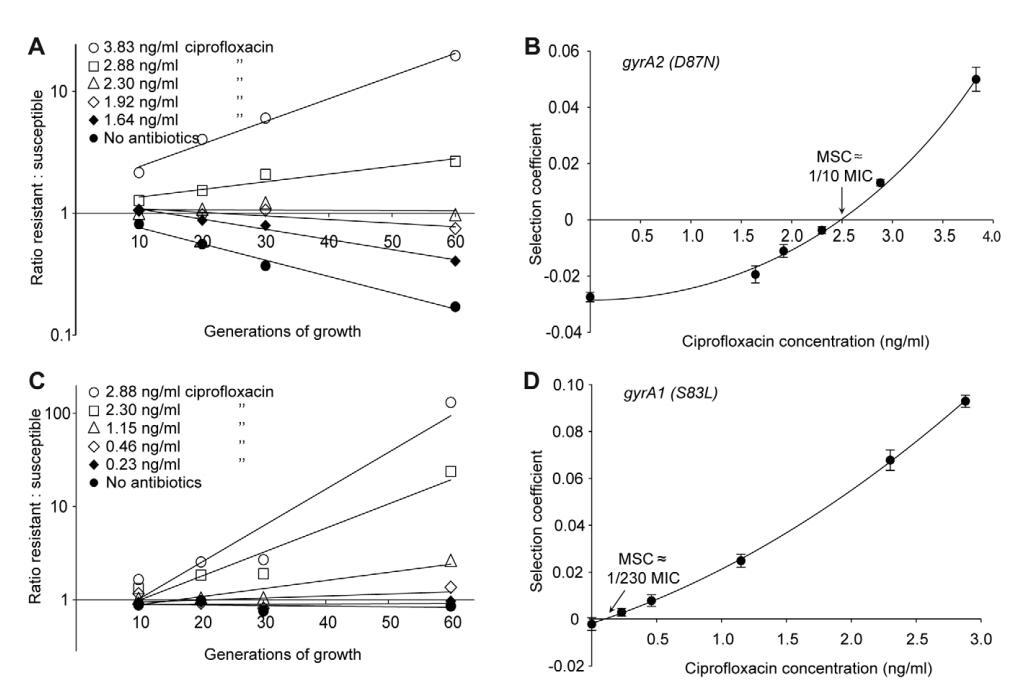
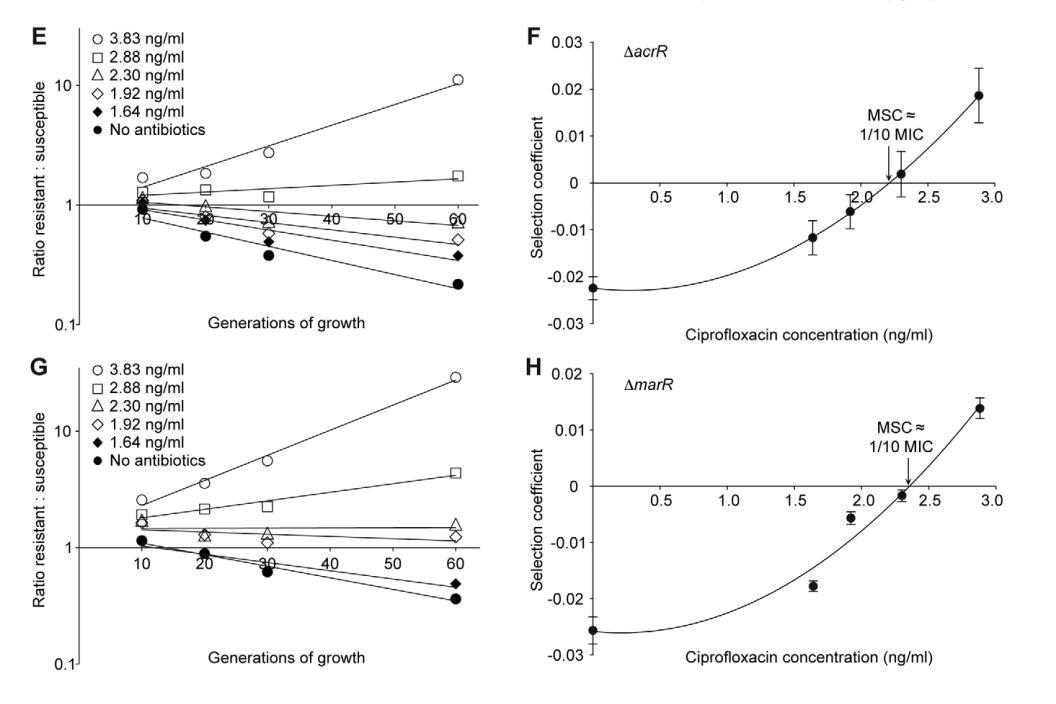
图3。敏感菌株和耐药菌株环丙沙星之间的竞争实验。在不同浓度的环丙沙星(A(gyrA2(D87N))、C(gyrA1(S83L))、E(DacrR)和G(DmarR))下进行竞争实验,并计算选择系数作为抗生素浓度(B、D、F和H)的函数。图A、C、E和G分别基于一次竞赛实验(三次竞赛的平均值),而图B、D、F和H则根据6次竞赛的选择系数计算(文本S1中的表S3)。显示了平均值的标准误差。doi:10.1371/期刊。ppat。1002158.g003
我们还计算了(正文S1中的附录)在低抗生素浓度下,由突变率(u)、群体规模(N)和抗生素存在时的适应性优势(s)决定的新产生的耐药突变体在易感人群中接管的速度。s取决于MSC上方的抗生素浓度,如图2和图3所示。当最初不存在抗性突变体时,固定时间可以表示为
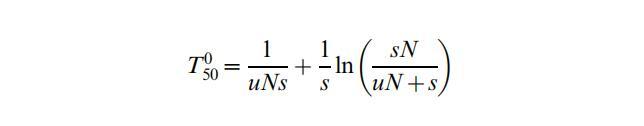
第一项是第一个存活突变体出现的随机等待时间,第二项是从随后的生长到50%的存在。对于较小的uN值0.1,第一项占主导地位,固定速度可能较慢。对于较大的值,uN.1,第二项占主导地位,固定可能很快,在0.1-0.01之间的s约为100-1000代(图6)。在这个限度内,抗性突变体出现的频率如此之高,以至于如果它们最初出现与否,对固定时间几乎没有影响。在这种情况下,值得注意的是,几种抗生素的亚MIC水平(对氟喹诺酮类药物最为明显)已被证明会增加细菌突变率,这可能会缩短等待时间,从而增加突变接管率[18]。
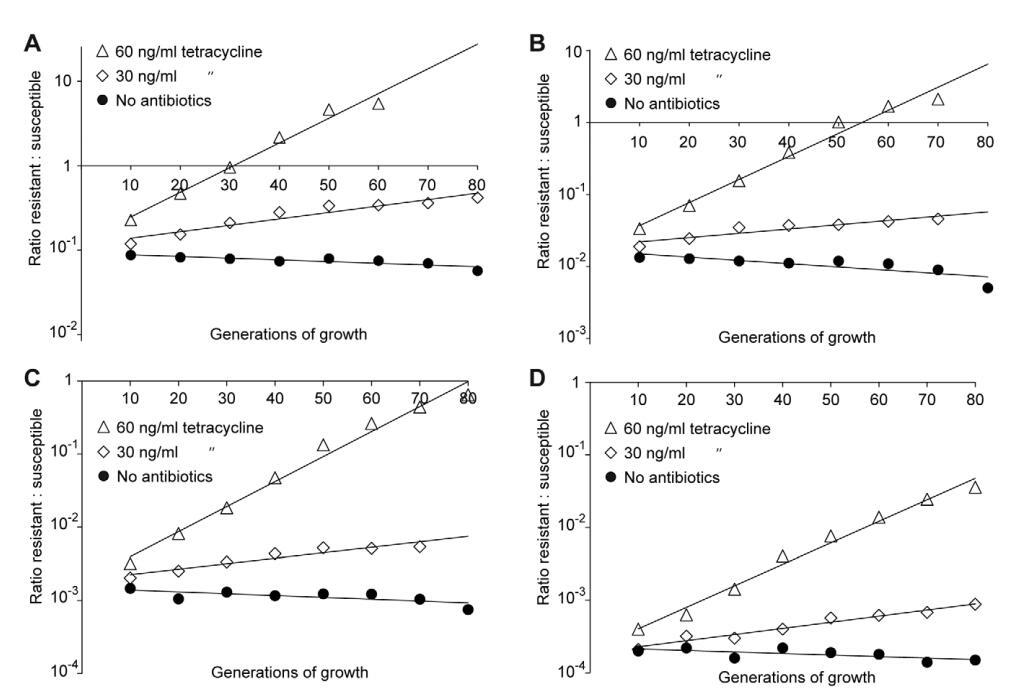
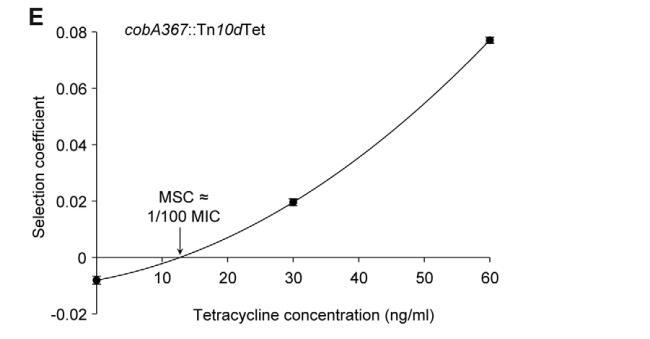
图4。用低初始频率的抗性突变体进行竞争实验。在不同浓度的抗生素和耐药突变体的不同起始组分下进行竞争实验。(A)对抗性突变体敏感的初始比例为10:1。(B)对抗性突变体敏感的初始比例为102:1。(C)对抗性突变体敏感的初始比例为103:1。(D)对抗性突变体敏感的初始比例为104:1。(E)计算选择系数作为抗生素浓度的函数。图A至图D分别基于一个单一竞争实验,而E则根据24个独立竞争的选择系数计算得出,其中有四个不同的抗性突变体起始部分(文本S1中的表S3)。显示了平均值的标准误差。doi:10.1371/期刊。ppat。1002158.g004
相关新闻推荐
1、乙醇耐受性梭菌菌株生长、基因组学、途径工程及发酵特性(一)
2、大肠埃希菌的噬菌体DK-13生物学特性及对污染猪肉的杀菌作用(一)
3、自然发酵鲊肉粉中筛选乳酸菌和葡萄球菌生长曲线及生物学特性(三)