2.7.时序寿命分析
对于稳定期培养物,将细胞在选择性SD培养基中于30°C、220 rpm振荡培养,直至细胞密度OD600约为5。将这些稳定期细胞洗涤两次并重悬于无菌蒸馏水中,OD600为1。将细胞在37°C下振荡培养,在此温度下细胞死亡率加快。每天对培养物取样。使用碘化丙啶(PI)荧光测定法进行细胞活力分析。
2.8.碘化丙啶染色
将酵母细胞悬浮在PBS pH 7.2中,浓度约为0.2 x 10^6个细胞/毫升,然后将1μl PI储备溶液(1 mg/ml)加入0.5 ml酵母细胞悬浮液中。样品在5-10分钟内在流式细胞仪上运行,该仪器能够测量红色荧光(带通滤波器>650)。不包括洗涤步骤。
2.9.流式细胞术
在流式细胞仪上进行FACS。使用15 mW氩离子激光器,在488 nm激发波长下分析PI染色。通过675带通滤波器,通过FL3检测器测量PI作为红色信号。每个样品检测至少10,000个事件。使用CELLQuest软件进行多变量数据分析。
3.结果
3.1.人铁蛋白L改善了Dyfh1突变体的生长速率
由于FL在哺乳动物系统中具有抗氧化和铁解毒功能,我们询问FL在酵母中是否具有类似功能。酵母缺乏铁蛋白基因,并且有研究表明酵母蛋白YFH1p(人frataxin的同源物)在铁储存中发挥作用。因此,我们将人铁蛋白L链转化到酵母frataxin敲除菌株Δyfh1中并进行互补实验。通过PCR生成长度完整的人铁蛋白L(FL)基因,克隆到酵母表达载体pSCGAL10-SN(附加体质粒)中,然后转化到酵母Δyfh1菌株FKEN01501A(AL)中。作为对照,将空载体转化到Δyfh1或其亲本WT菌株中。Northern印迹分析显示,在诱导型SG培养基中FL亚基的mRNA水平很高,而在非诱导型SD和SR培养基中表达较弱(图1)。
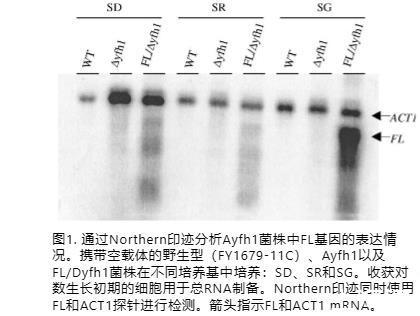
在非诱导型SD和SR培养基中观察到的低水平FL mRNA可能是由于GAL10启动子的泄漏所致,已知高拷贝数载体会发生这种情况。注意到Δyfh1菌株在SD培养基中生长良好,在SR培养基中生长缓慢,在SG培养基中生长不良(数据未显示),我们在大多数实验中使用SR培养基。通过Bioscreen测量的FL/Δyfh1和Δyfh1代表性转化子的生长速率如图2A所示。有趣的是,人FL基因的表达改善了Δyfh1突变体的生长,但并未完全恢复到WT水平。
3.2.在Δyfh1突变体中表达铁蛋白L可解毒过量的铁
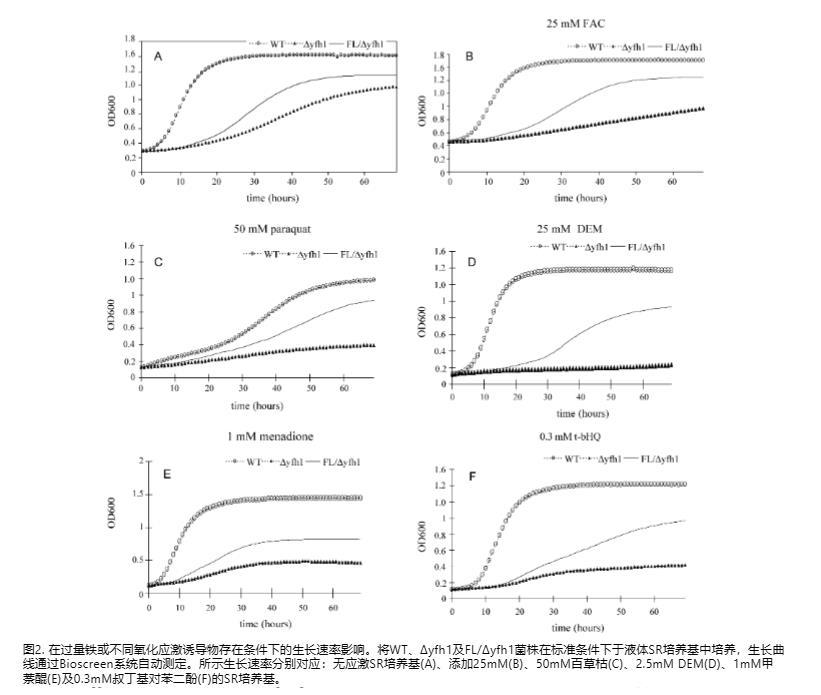
为了研究是否是FL的铁结合活性负责挽救frataxin缺陷菌株的生长缺陷,我们测量了酵母在含有过量铁的培养基中的生长速率。正如预期的那样,FL转化子显示出对过量铁的显著耐受性,而frataxin缺失突变体无法解毒铁过量并表现出生长速率降低(图2B)。FL逆转外源铁生长抑制效应的能力表明,Δyfh1中生长速率降低是由过量游离铁介导的,这可能导致ROS水平升高。
3.3.铁蛋白L保护Δyfh1菌株免受氧化剂诱导的细胞死亡
接下来我们检查FL是否也能提高Δyfh1背景菌株耐受氧化剂的能力。在存在50 mM百草枯、2.5 mM马来酸二乙酯(DEM)、1 mM甲萘醌和300μM叔丁基氢醌(t-bHQ)的情况下测量细胞生长。如图2C-F所示,Δyfh1菌株对各种氧化剂过敏。然而,FL转化子显示出对氧化应激的更大耐受性和改善的生长,尽管后者未达到野生型的水平。
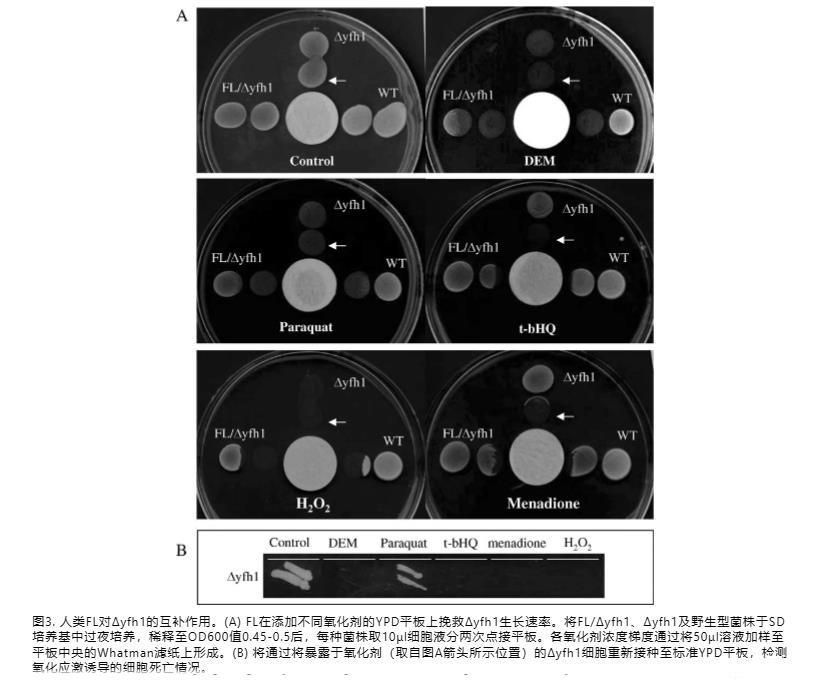
为了验证FL转化恢复生长是由于保护细胞免受氧化剂诱导的死亡,在含有氧化剂浓度梯度的固体YPD平板上分析细胞生长。通过将50μl不同的氧化剂(97%DEM、1 M百草枯、1 M甲萘醌、2M t-bHQ溶于DMSO,或3%H2O2)滴在含有YPD培养基的培养皿中央的Whatman纸上形成梯度。铁蛋白转化子比未转化的frataxin突变体表现出更强的氧化应激抵抗力;铁蛋白互补改善了细胞生长,尽管未达到WT水平(图3A)。为了区分氧化应激诱导的frataxin缺陷细胞生长停滞是由于细胞死亡还是生长抑制,我们将生长停滞的Δyfh1细胞铺板在没有应激诱导剂的YPD培养基上。3天后检查它们。先前用DEM、甲萘醌、t-bHQ或H2O2处理过的培养物中的细胞没有生长,证明这些氧化剂导致了细胞死亡(图3B)。然而,先前用百草枯处理过的培养物中的细胞生长良好,表明百草枯在不杀死细胞的情况下停止了生长(图3B)。
3.4.FL保护蛋白质免受损伤
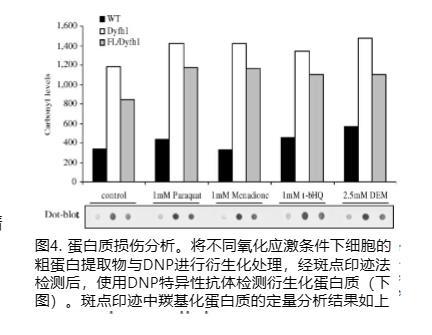
众所周知,大多数氧化剂会引起细胞蛋白质的氧化修饰。因此,我们使用点印迹分析比较了Δyfh1、WT和FL/Δyfh1中的蛋白质羰基化。图4描述了一个代表性的点印迹模式示例,该模式使用抗DNP抗体检测羰基化蛋白质。在标准或氧化应激生长条件下,缺陷型frataxin菌株显示羰基化蛋白质总量比其WT显著增加2.6-4.3倍。有趣的是,在相同的生长条件下,FL明显降低了Δyfh1菌株中羰基化蛋白质的总量,降低了17-28%。
3.5.FL部分挽救了Δyfh1突变体的寿命
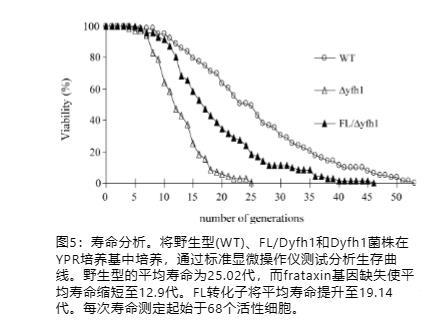
一个普遍的观察结果是氧化损伤导致衰老。酵母衰老的经典研究基于复制寿命的测量,通常通过计算母细胞在衰老前经历的分裂次数来衡量。由于frataxin突变酵母积累氧化应激,因此我们推断frataxin失活可能降低酵母的寿命,如果是这样,人铁蛋白L是否可以修复这种缺陷。为了测试这种可能性,我们在Δyfh1、其亲本菌株WT和铁蛋白转化子FL/Δyfh1中进行了寿命分析。在固体YPR培养基上进行通过显微操作的复制寿命测定,因为Δyfh1菌株在合成固体培养基上几乎不生长(数据未显示)。如图5所示,Δyfh1的复制寿命平均比WT短49%,表明frataxin确实参与酵母的寿命。有趣的是,在Δyfh1背景中转化人铁蛋白L可以挽救细胞免于死亡,并且FL/Δyfh1的寿命达到了其WT值的76.5%。
相关新闻推荐
2、微生物生长曲线分析仪评估藤黄微球菌角蛋白酶生产条件及分解潜力(一)
3、动物双歧杆菌NX-6生长曲线测定、斑马鱼降脂功效实验及促进脂肪代谢机制研究(一)
