三、研究结果
3.1.贯叶连翘提取物对细菌增殖的影响
如图1A所示,贯叶连翘提取物对大肠杆菌、阴沟肠杆菌、肺炎克雷伯菌、金黄色葡萄球菌和藤黄微球菌的MIC值分别为40 mg/mL、>80 mg/mL、>80 mg/mL、40 mg/mL、20 mg/mL,表明贯叶连翘提取物对大肠杆菌、金黄色葡萄球菌和藤黄微球菌表现出显著的抗菌活性。特别是在测试的菌株中,藤黄微球菌是对贯叶连翘提取物最敏感的细菌。因此,选择藤黄微球菌作为后续研究贯叶连翘提取物抗菌活性和机制的指示菌。
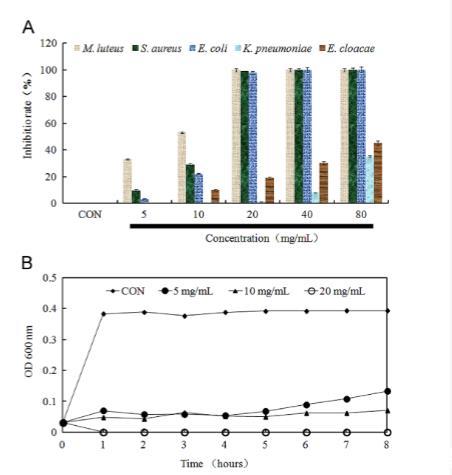
图1.长柱金丝桃提取物对细菌增殖的影响。(A)长柱金丝桃提取物对测试菌株的最小抑菌浓度值。使用Synergy 4酶标仪在490 nm波长下测定各孔吸光度。(B)时间-效应关系检测。通过自动化测量系统在600 nm波长下测定吸光度。以未经长柱金丝桃提取物处理的藤黄微球菌作为对照组。
3.2.贯叶连翘提取物对藤黄微球菌的抗菌作用
如图1A所示,贯叶连翘提取物对藤黄微球菌的MIC值为20 mg/mL,MBC值等于MIC。此外,时间-效应关系测定的结果也显示,贯叶连翘提取物在20 mg/mL浓度下可以杀死细菌(图1B),表明贯叶连翘提取物可能是一种对藤黄微球菌的杀菌剂。
3.3.贯叶连翘提取物对藤黄微球菌细胞蛋白质的影响
如图2所示,与对照组相比,在10 mg/mL和15 mg/mL浓度的贯叶连翘提取物作用下,藤黄微球菌细胞的蛋白质被切割成小于10 kDa的片段。这些结果表明,贯叶连翘提取物可以显著破坏藤黄微球菌维持正常生命活动所需的蛋白质合成,最终杀死藤黄微球菌细胞。
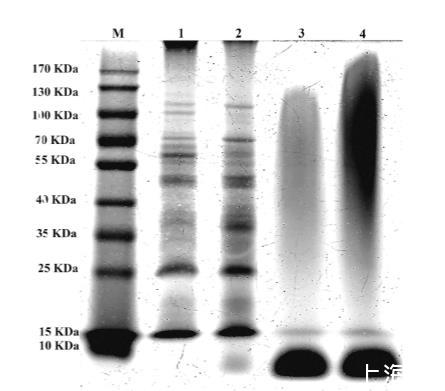
图2.长柱金丝桃提取物对藤黄微球菌细胞蛋白质的影响。藤黄微球菌细胞蛋白质经12.0%SDS-PAGE分离,并用考马斯亮蓝染色显影。M泳道:标记蛋白;1泳道:未经长柱金丝桃提取物处理的藤黄微球菌细胞(CON);2泳道:经5 mg/mL长柱金丝桃提取物处理的藤黄微球菌细胞;3泳道:经10 mg/mL长柱金丝桃提取物处理的藤黄微球菌细胞;4泳道:经15 mg/mL长柱金丝桃提取物处理的藤黄微球菌细胞。
3.4.贯叶连翘提取物对藤黄微球菌细胞凋亡的影响
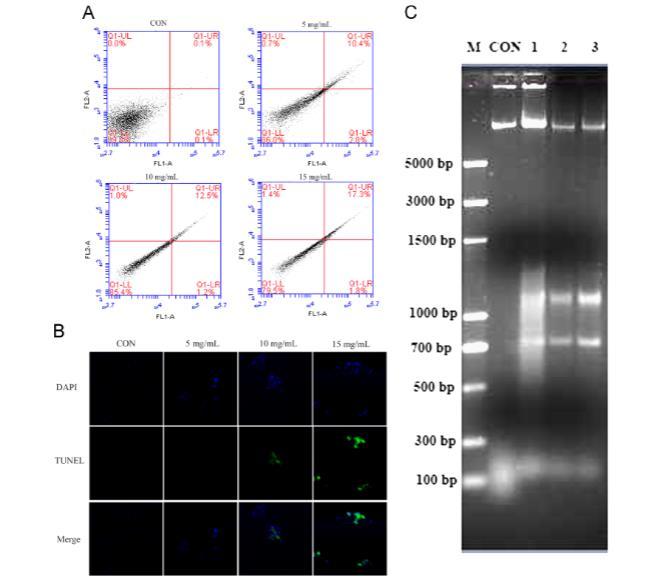
图3.长柱金丝桃提取物诱导藤黄微球菌细胞凋亡。(A)Annexin V/PI染色结果。细胞被分为存活细胞、坏死细胞、早期凋亡细胞和晚期凋亡细胞。(B)TUNEL检测结果。TUNEL阳性细胞(绿色通道)。DAPI(蓝色通道)用于定位细胞核。(C)DNA laddering检测结果。DNA被分离并在用溴化乙锭染色的1.0%琼脂糖凝胶上可视化。泳道M:标记;泳道1:未经长柱金丝桃提取物处理的藤黄微球菌细胞(CON);泳道2:经5 mg/mL长柱金丝桃提取物处理的藤黄微球菌细胞;泳道3:经10 mg/mL长柱金丝桃提取物处理的藤黄微球菌细胞;泳道4:经15 mg/mL长柱金丝桃提取物处理的藤黄微球菌细胞。
如图3A所示,在用载体培养8小时后,阴性组中仅发现少量凋亡细胞(0.1±0.8%)。然而,在用不同剂量的贯叶连翘提取物处理后,凋亡细胞的百分比从10.4±2.8%显著增加到17.3±1.8%。此外,在对照组中几乎检测不到TUNEL阳性细胞,而在贯叶连翘提取物处理的藤黄微球菌细胞中,TUNEL阳性信号以剂量依赖性方式显著增加(图3B),证明用贯叶连翘提取物处理会导致藤黄微球菌DNA断裂。此外,当凋亡发生时,DNA被切割成180-200 bp的寡核苷酸片段。在本研究中,琼脂糖凝胶电泳表明,藤黄微球菌细胞暴露于贯叶连翘提取物会导致明显的DNA断裂,而对照组未显示任何DNA梯状条带,如图3C所示。
总之,这些结果表明贯叶连翘提取物可以剂量依赖性地通过凋亡途径诱导藤黄微球菌细胞死亡。
3.5.贯叶连翘提取物对藤黄微球菌细胞膜电位的影响
为了测试贯叶连翘是否通过破坏细胞膜诱导藤黄微球菌凋亡,使用Rhodamine 123染色分析细胞膜电位(ΔΨm)。如图4所示,当藤黄微球菌细胞用5、10、15 mg/mL的贯叶连翘提取物处理指定时间后,膜电位(ΔΨm)发生崩溃。观察结果表明,贯叶连翘提取物可能通过膜介导的凋亡途径发挥促凋亡作用。

图4.经Hypericum ascyron L.提取物处理后藤黄微球菌细胞膜电位丧失情况。采用罗丹明123染色法测定膜电位(Δψm),并通过流式细胞术进行分析。未经Hypericum ascyron L.提取物处理的藤黄微球菌细胞作为对照组。
四、讨论
在本研究中,我们发现贯叶连翘提取物对革兰氏阳性菌,尤其是藤黄微球菌,具有明显的抗菌活性,且呈时间和剂量依赖性。贯叶连翘提取物可以显著破坏藤黄微球菌维持正常生命活动所需的蛋白质合成,从而诱导藤黄微球菌细胞死亡。
此处,本研究显示贯叶连翘对革兰氏阳性菌,尤其是藤黄微球菌的抗菌作用似乎强于对革兰氏阴性菌的作用。众所周知,革兰氏阳性菌和革兰氏阴性菌的细胞壁存在显著的结构差异,例如后者具有外膜和独特的周质空间。我们认为,革兰氏阳性菌缺乏外脂多糖膜可能允许金丝桃属代谢物更容易渗透到细胞中。
凋亡通常被称为生理性程序性细胞死亡,不同于坏死。细胞凋亡涉及细胞数量和生命活动的生物学调控,是一个重要的代谢过程。凋亡通过激活细胞内在的自杀机制发生。最近的研究揭示了细菌中凋亡性死亡的证据,并表明凋亡途径的激活参与了抗菌药物的功能。Dwyer等人发现,除了膜去极化和DNA断裂外,细菌中的凋亡样死亡还以磷脂酰丝氨酸暴露于质膜外叶和染色体浓缩为特征。在我们的研究中,随着贯叶连翘提取物浓度的增加,细菌细胞的凋亡率呈剂量依赖性增加(图3A),并且TUNEL测定的结果一致(图3B)。在生物化学上,凋亡的特征是内源性核酸酶的激活和DNA降解成180-200 bp的倍数片段,这在我们研究中的DNA断裂测定中也可见到(图3C)。这些结果表明,贯叶连翘提取物诱导的藤黄微球菌细胞死亡主要是由于凋亡。
活性氧(ROS)是呼吸生物代谢的天然副产物。ROS合成的诱导导致高反应性自由基的形成,从而破坏细胞。通过形成自由基抑制细菌生长也被观察到。ROS的过量产生可以攻击细菌细胞膜脂质,然后导致细菌细胞膜功能崩溃。ROS的产生和膜电位(ΔΨm)的破坏有助于药物诱导的死亡。在本研究中,用贯叶连翘提取物处理的藤黄微球菌细胞的膜电位显著丧失(图4),证明贯叶连翘提取物诱导的藤黄微球菌细胞凋亡可能是通过膜介导的凋亡途径。
据我们所知,这是第一篇关于贯叶连翘抗菌机制的论文。我们小组正在进行提取物的分离和化学表征,这为利用贯叶连翘的自然资源提供了可持续的可能性。总之,我们的数据可能为贯叶连翘在临床上的使用提供合理基础,并为开发新型抗菌药物提供启示。
相关新闻推荐
1、铜绿假单胞菌Pa021的分离及鉴定、一步生长曲线、杀菌曲线绘制
2、高灵敏度竞争实验:亚最小抑制浓度下耐药菌突变体的选择与富集(二)
3、非无菌制剂中常见的微生物一一枯草芽孢杆菌不同水分活度的时间生长曲线
