最小抑制浓度测量
四环素和环丙沙星的最小抑制浓度测定通过肉汤宏稀释在10 mL管中进行。含Mueller-Hinton肉汤(1 mL)补充不同浓度抗生素的管接种1μL 37°C过夜细菌培养物。管在37°C振荡孵育16至18小时,四环素培养物避光防止抗生素降解。最小抑制浓度设定为无可见生长的最低抗生素浓度。链霉素最小抑制浓度通过Etest根据制造商说明(AB bioMerieux,Solna,Sweden)测定。Etest在Mueller-Hinton琼脂板上进行,37°C孵育16-18小时。
竞争实验
有限采样竞争者(<10^3细胞)常在竞争实验中引入统计不确定性,更准确的耐药突变体与野生型细胞比例测量可通过染色体拷贝青色(cfp)或黄色(yfp)变体绿色荧光蛋白基因(gfp)辅助获得。这些允许使用荧光激活细胞分选器追踪大量单细胞(10^5细胞)。cfp/yfp基因使用λRed系统如前描述插入galK,并通过噬菌体P22转导或噬菌体P1转导移动到各种菌株。
过夜在Mueller-Hinton培养基中生长的敏感野生型菌株与cft或yft之一混合1:1、10:1、10^2:1、10^3:1和10^4:1与携带另一标记的同基因耐药突变体,并通过每24小时1000倍系列稀释(导致每次传代10代生长)维持长达4至6次系列传代。群体中耐药与敏感细胞比例在每次系列传代通过使用荧光激活细胞分选器(BD FacsAria)计数10^5细胞确定。选择系数使用回归模型确定,如前描述,其中R是耐药与敏感比例。此方案允许可重复测定小至s=0.003的适应性差异。还包括两套独立构建的每个野生型菌株,标记有cfp或yfp,以测量有cfp标记相对于yfp标记对生长速率的相对影响。这些对照实验显示超过40代竞争,标记间成本差异对生长速率影响可忽略。以低初始比例耐药突变体进行的竞争实验使用四环素进行,因新发四环素耐药突变体出现所需时间长可能干扰竞争实验。
新发进化耐药突变体的富集
为调查亚抑制抗生素浓度是否也可以选择新发耐药突变体,敏感细菌在链霉素最小抑制浓度的1/4和环丙沙星最小抑制浓度的1/10下系列传代。总共20个鼠伤寒沙门氏菌LT2独立谱系通过每24小时在含1μg/ml链霉素的Mueller-Hinton培养基中1 mL批量培养1000倍稀释系列传代700代(每次传代10代生长),和20个大肠杆菌MG1655独立谱系通过每24小时在含2.3 ng/ml环丙沙星的Mueller-Hinton培养基中1 mL批量培养1000倍稀释系列传代600代。谱系从独立菌落过夜培养物开始,使用约10^4细胞初始瓶颈以最小化预存耐药突变体数量。每个培养物中耐药细胞百分比通过每100代铺板约10^5细胞到含不同浓度抗生素的LB琼脂上并计数菌落数监测。这些细胞子集在同一抗生素浓度上重新划线以确认耐药性。
结果
初始检查低抗生素浓度效应的实验在单一培养中进行,其中敏感野生型和携带Tn10dTet的耐药突变体分别在四环素不同浓度下生长。如图1B所示,远低于敏感最小抑制浓度的浓度降低了敏感菌株的指数生长速率,而对耐药菌株无明显影响。例如,在敏感最小抑制浓度1/30的浓度下,敏感菌株生长比无抗生素时慢约15%,而耐药突变体似乎未受影响,表明耐药菌株在这些低浓度下被强烈选择。为提高测定灵敏度并检测极微小的生长速率差异,我们进行了敏感和耐药菌株对之间的竞争实验。
敏感和耐药突变体的最小抑制浓度为:鼠伤寒沙门氏菌野生型(链霉素=4μg/ml,四环素=1.5μg/ml),rpsL K42R>1024μg/ml和Tn10dTet菌株=128μg/ml;大肠杆菌野生型(环丙沙星=0.023μg/ml),gyrA S83L(环丙沙星=0.38μg/ml),gyrA D87N(环丙沙星=0.25μg/ml),ΔacrR(环丙沙星=0.047μg/ml)和ΔmarR(环丙沙星=0.047μg/ml)。菌株通过绿色荧光蛋白基因变体(yfp和cfp,分别编码黄色和青色荧光蛋白)进行遗传标记,允许通过荧光激活细胞分选计数大群体竞争细胞,从而显著减少与小群体计数相关的实验误差。竞争菌株除耐药决定子和产生各自荧光蛋白的yfp和cfp基因外为同基因。对照实验显示cfp和yfp标记之间的适应性成本差异对生长速率影响可忽略。
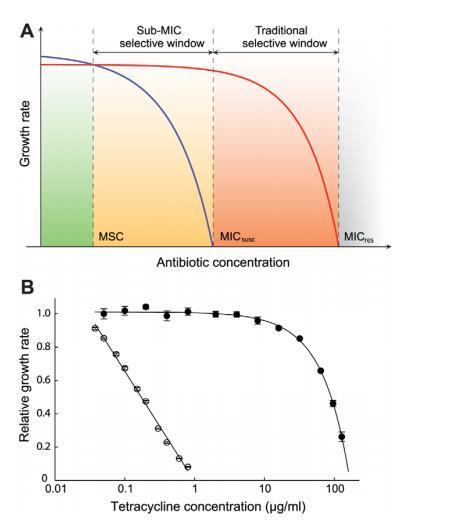
图1. 抗生素浓度对生长速率的影响。(A) 抗生素浓度与生长速率关系的示意图。绿色区域表示敏感菌株(蓝色曲线)将胜过耐药菌株(红色曲线)的浓度区间。橙色(亚MIC选择窗口)和红色(传统突变体选择窗口)分别表示耐药菌株将胜过敏感菌株的浓度区间。其中,MICsusc为敏感菌株的最低抑菌浓度,MICres为耐药菌株的最低抑菌浓度,MSC为最低选择浓度。(B) 肠炎沙门氏菌敏感株(空心圆)与耐药株(实心圆)在四环素浓度下的相对指数生长速率。图中标注了均值的标准误差。相对生长速率1.0对应约1.8小时21。实验在37°C的穆勒-欣顿培养基中进行。
菌株在批量培养中通过系列传代在四环素、环丙沙星(一种氟喹诺酮)和链霉素(一种氨基糖苷类)的不同浓度下或无药物下竞争长达80代(图2A-D,图3A-H,图4A-E)。如我们先前研究所示,此实验设置允许检测至少小至0.3%的生长速率差异,接近周期性选择事件干扰设定的灵敏度极限。而图1B所示的生长速率测量仅测量指数生长期,竞争实验代表滞后相、指数相和静止相生长和存活的复合体,允许检查整个生长周期。
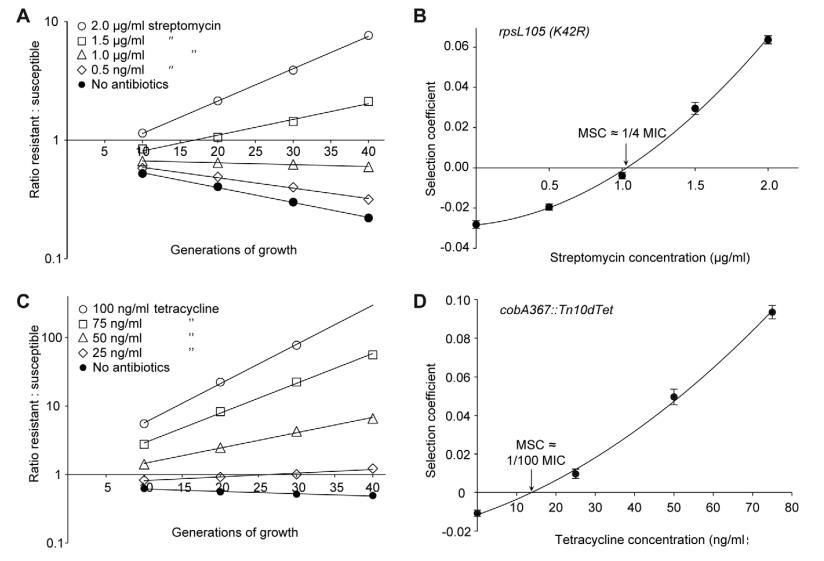
图2. 易感菌株与抗性菌株、链霉素与四环素之间的竞争实验。不同抗生素浓度(A(rpsL105(K42R))和 C(Tn10dtet))下的竞争实验,以及计算的选择系数随抗生素浓度的变化(B 和 D)。图 A 和 C 均基于单次竞争实验(四次实验的平均值),而图 B 和 D 则根据多达 20 次竞争实验的选择系数计算得出。均值的标准误差已标出。
图2A、C、图3A、C、E、G和图4A-D所示数据展示了耐药:敏感菌株比例随生长代数在不同抗生素浓度下的变化。每条线代表一次竞争实验,斜率是选择系数(s值)的度量。因此,无抗生素时获得的负斜率是抗生素耐药机制适应性成本的度量,正斜率表明耐药突变体被富集。当从这些实验获得的s值绘制为抗生素浓度函数时,截距s=0代表我们指定的最小选择浓度(MSC),其中耐药性的适应性成本与抗生素对耐药突变体的选择相平衡(图2B、D,图3B、D、F、H和图4E)。
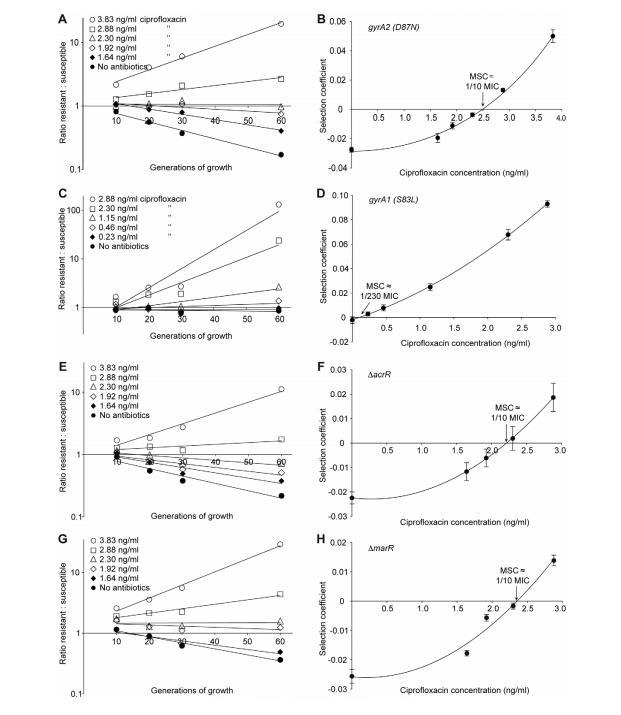
图3. 敏感菌株与耐药菌株在环丙沙星中的竞争实验。图中展示了不同浓度环丙沙星(A(gyrA2(D87N))、C(gyrA1(S83L))、E(DacrR)和G(DmarR))的实验结果,以及抗生素浓度对选择系数的影响(B、D、F和H)。其中图A、C、E、G基于单次实验数据(三次实验的平均值),而图B、D、F、H则根据六次实验的选择系数计算得出。图中均标注了均值的标准误差。
取决于抗生素和检查的耐药突变类型,MSC在敏感最小抑制浓度的1/4至1/230之间变化。对于链霉素,MSC值为敏感菌株最小抑制浓度的1/4(图2B),对于四环素为1/100(图2D),对于环丙沙星,根据特定耐药突变,在敏感最小抑制浓度的1/10(图3B)至1/230(图3D)之间变化。这些值对应绝对抗生素浓度1μg/ml(链霉素)、15 ng/ml(四环素)和2.5 ng/ml至100 pg/ml(环丙沙星)。以低初始比例耐药突变体进行的竞争也显示选择系数与耐药突变体初始频率无关。即使初始频率低至10⁻⁴,也能观察到与1:1比例相同的耐药突变体富集(即相同选择系数)(比较图2D和图4E)。
相关新闻推荐
2、耐万古霉素粪肠球菌噬菌体一步生长曲线、温度和pH稳定性分析(二)
