摘要
生物素蛋白连接酶(BPL)广泛存在于生命的三个域中。范式BPL是大肠杆菌BirA蛋白,它还作为生物素生物合成途径的阻遏蛋白。本文报告乳酸乳球菌拥有两个不同的birA直系同源物(birA1_LL和birA2_LL)。与大肠杆菌的情况不同,乳酸乳球菌似乎是生物素营养缺陷型,因为它缺乏完整的生物素生物合成途径。相反,它保留了两个生物素转运蛋白编码基因(bioY1_LL和bioY2_LL),表明其采用清除策略从环境中获取生物素。通过两个乳酸乳球菌birA基因补充条件致死性大肠杆菌birA突变体的能力,判断了它们的体内功能。薄层色谱和质谱分析表明,这两种重组BirA蛋白通过预期的生物素酰-AMP中间体,催化受体生物素羧基载体蛋白(BCCP)的生物素化反应。凝胶迁移实验用于表征bioY1_LL和BirA1_LL。我们还测定了乳酸乳球菌摄取³H-生物素的能力。总之,我们的结果解读了益生菌细菌乳酸乳球菌中存在的具有冗余基因的独特生物素清除途径。
生物素(维生素H)对生命三个域至关重要。生物素是中心代谢中共价结合的酶辅因子,例如形成脂肪酸构建块丙二酰-CoA所需的乙酰-CoA羧化酶(ACC)反应¹。大多数细菌合成生物素。然而,一些细菌必须从环境中清除生物素。BioY是许多细菌中发现的生物素转运蛋白。通常,BioY被认为是能量耦合因子转运家族(ECF)的底物结合组分(S组分),ECF是一种参与多种微量营养素摄取的ATP结合盒转运蛋白。大肠杆菌既可以合成生物素,也可以使用非BioY/ECF机制转运生物素⁷。有趣的是,猪链球菌(一种动物病原体)中生物素的获取完全依赖于BioY转运蛋白的存在,因为它缺乏生物素合成途径⁴。Hebbeln及其同事报道了α-变形菌门红杆菌中三联生物素转运蛋白BioMNY的体外生物化学²。尽管乳酸乳球菌BioY膜蛋白的晶体结构已被报道⁸,但bioY的调控表达和BirA守门蛋白介导的生物素感知仍未知。
乳酸乳球菌IL1403是低GC革兰氏阳性细菌组的成员。通常认为它在植物上休眠,但在胃肠道内生长。鉴于乳酸乳球菌在牛奶中剧烈发酵乳糖,产生ATP和乳酸,它已被广泛应用于乳制品行业,如酪乳和奶酪生产。由于其在食品发酵中的长期作用,乳酸乳球菌被普遍认为是安全的(GRAS)状态。乳酸乳球菌存在于动物和人类肠道中,显著有益于免疫系统,通常被视为益生菌。令人意外的是,乳酸乳球菌IL1403具有小基因组(2.37 Mb),估计仅为大肠杆菌基因组(MG1655为4.64 Mb)的一半,却在脂质代谢以及生物素利用途径中编码许多冗余(和/或重复)基因座。虽然出乎意料,但这种安排并非没有先例,因为在副球菌属中观察到类似情况。这种在乳酸乳球菌最小基因组中存在生物素代谢冗余基因的罕见情况可能提供一些未知的生理优势,提出了一种可能性:它代表了细菌进化及其环境生态位选择的遗迹。
本文中,我们对生物素代谢背景下的冗余基因进行了系统功能分析。我们证明了乳酸乳球菌生物素转运的体内证据,并确定了两个BirA直系同源物的不同功能分配。最后,我们formulated了乳酸乳球菌生物素清除的工作模型(图1)。两种不同生物素蛋白连接酶的非典型出现可能表明其适应生长环境和/或生态位的独特进化历史。
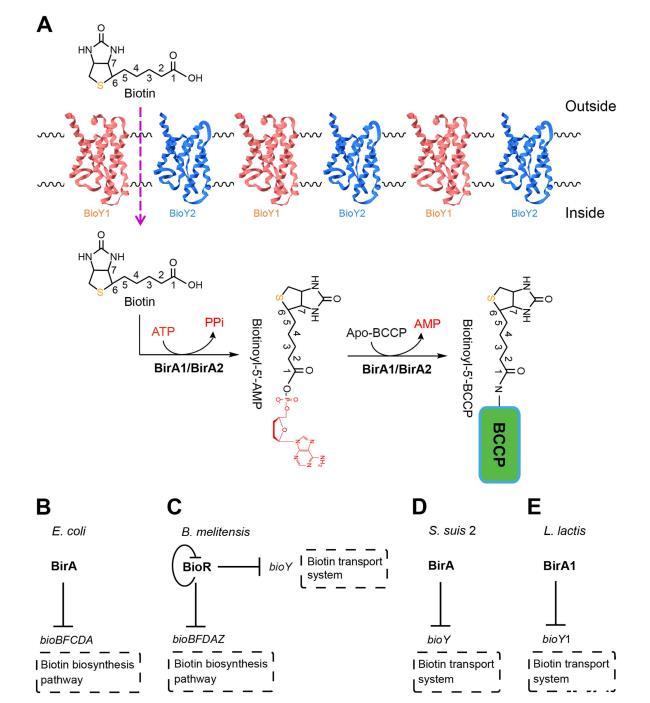
图1.当前关于生物素吸收及BirA蛋白生物素连接酶/阻遏物功能的模型。(A)乳酸乳球菌中生物素吸收与利用的假说通路,展示了BirA介导的BCCP生物素化反应的两个半反应。(B)大肠杆菌BirA抑制生物素合成通路。(C)梅里蒂斯芽孢杆菌BioR抑制生物素合成通路及生物素转运系统的表达。(D)猪链球菌BirA对bioY基因的转录抑制作用。(E)乳酸乳球菌BirA1抑制bioY基因的表达。
方法
细菌菌株和生长条件
使用的大肠杆菌菌株包括MG1655、BM4092(birA的Km突变体)、DH5α和BL21(DE3)。使用乳酸乳球菌IL1403°和猪链球菌2菌株进行功能分析。使用Luria Bertani(LB)和丰富肉汤(RB)培养大肠杆菌,使用Todd Hewitt Broth(THB)和基本培养基维护乳酸乳球菌IL1403和猪链球菌2。必要时添加抗生素(单位mg/升):氨苄钠,100;硫酸卡那霉素,50。
质粒和遗传操作
通过PCR扩增两个birA基因(birA1[L0191]和birA2[L0192]),并克隆到表达载体pET28(a)中以创建用于亲和纯化的组氨酸标签蛋白,以及克隆到阿拉伯糖诱导载体pBAD24中用于基因互补实验,如先前所述。将pET28衍生物导入BL21(DE3)进行蛋白质生产,而表达birA的pBAD24衍生物转化到birA的Km突变体(BM4092)中进行birA功能测定。所有获得的质粒通过PCR和DNA测序验证。
蛋白质纯化
如先前所述进行截短AccB(AccB87)apo受体蛋白的表达、纯化和定量。从1升LB培养物中纯化重组BirA1_LL和BirA2_LL蛋白,培养物在37°C生长至OD600为0.8,通过添加0.5 mM IPTG在30°C诱导蛋白质生产4小时。使用先前描述的方案²⁸进行细胞裂解和蛋白质纯化。纯化的蛋白质在储存缓冲液(含50 mM Tris-HCl[pH 8.0]、150 mM KCl、10%甘油和0.1 mM DTT)中透析过夜,使用Millipore浓缩器浓缩,闪冻,并储存在-80°C。所有蛋白质样品的纯度通过12%SDS-PAGE凝胶分离和考马斯亮蓝染色判断。
液相色谱
使用Waters Q-Tof API-US Quad-ToF质谱仪测定两个乳酸乳球菌BirA直系同源物(BirA1_LL和BirA2_LL)。从凝胶中切取目标蛋白条带,用胰蛋白酶(G-Biosciences St.Louis,MO)消化。最后,将所得肽段上样到Waters Atlantis C-18柱(0.03 mm颗粒,0.075 mm x 150 mm),获取的数据用于通过ms/ms进行进一步分析。
相关新闻推荐
1、耐万古霉素粪肠球菌噬菌体一步生长曲线、温度和pH稳定性分析(一)
2、小檗碱对代表性肠道菌群生长曲线的影响及抑制作用——材料与方法
