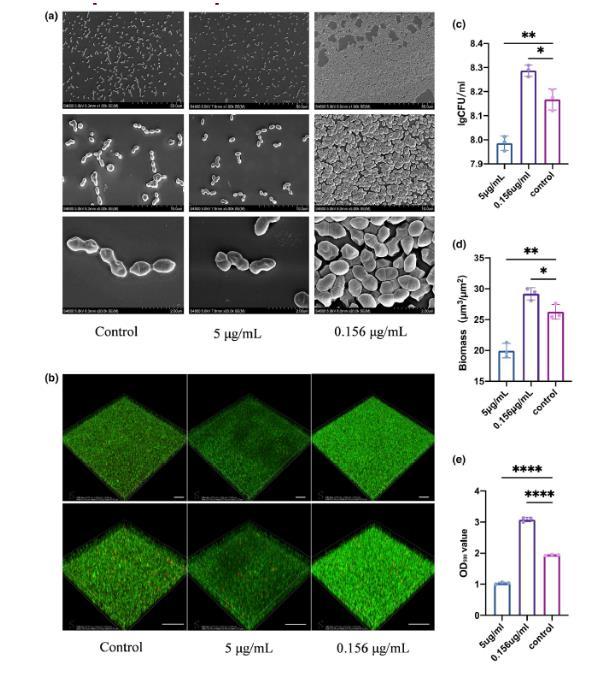
图3 、白色念珠菌EVs对粪肠球菌生物膜具有双重作用。(a)用不同浓度的EV处理后粪肠球菌生物膜形成的扫描电镜照片。(b)用不同浓度的EV处理后,粪肠球菌生物膜在细胞攀爬片上染色的代表性CLSM图像(比例尺=50μm)。(c)用不同浓度的EV处理的粪肠球菌生物膜的CFU。(d)基于共聚焦图像的粪肠球菌生物量定量。(e)用不同浓度的EV处理的粪肠球菌生物膜的结晶紫染色。数据以平均值±标准差表示。*p<0.05,**p<0.01,****p<0.0001。
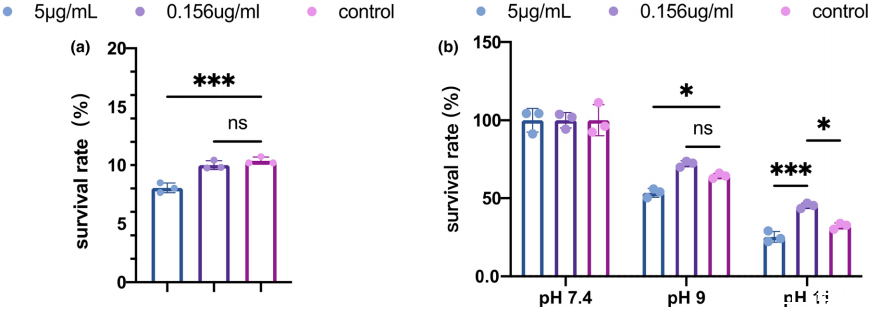
图4、 白色念珠菌EVs对粪肠球菌对有害环境的抵抗力具有双重作用。(a)粪肠球菌生物膜对3%NaOCl的存活率。(b)在饥饿碱性环境下培养的粪肠球菌生物膜的存活率。在pH9.0和11.0的PBS中的存活率由对照组(pH7.4)的细胞数标准化。数据以平均值±标准差表示。*p<0.05,***p<0.001,ns,无显著性。
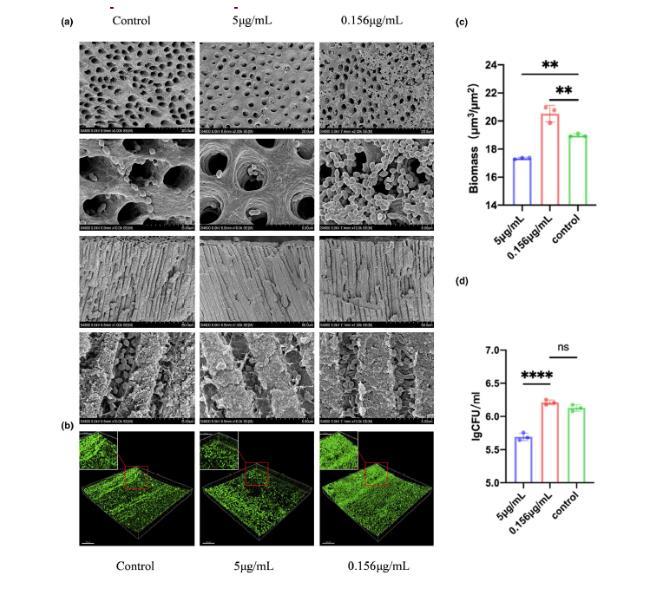
图5 、不同浓度的白色念珠菌EVs对粪肠球菌感染牙本质和在杜仲胶上形成生物膜的影响相反。(a)用不同浓度的EV处理后,根管壁和牙本质小管内粪肠球菌的扫描电镜照片。(b)用不同浓度的EV处理后,粪肠球菌生物膜在杜仲胶顶面染色的代表性图像(比例尺=50μm)。红色框显示了生物膜的部分放大视图(比例尺=20μm)。(c)基于共聚焦图像的粪肠球菌生物量定量。(d)与不同浓度EV共培养的杜仲胶上粪肠球菌生物膜的CFU。数据以平均值±标准差表示。*p<0.05,**p<0.01,****p<0.0001。
总结
研究表明粪肠球菌与白色念珠菌在治疗后牙髓病中存在重要关系。然而,对于真菌-细菌相互作用及其可能的功能途径了解较少。在本研究中,相关科研人员研究了源自白色念珠菌的细胞外囊泡对粪肠球菌生长和致病性的影响。从酵母氮源基础培养基中分离白色念珠菌EVs,观察并鉴定其形态、尺寸分布和蛋白浓度。使用生长曲线和菌落形成单位计数评估EVs对浮游态粪肠球菌的影响,而使用扫描电子显微镜和共聚焦激光扫描显微镜确定EVs对粪肠球菌生物膜的影响。检测了粪肠球菌抵抗不利环境、感染牙本质小管以及在牙胶尖上形成生物膜的能力。此外评估了EVs对粪肠球菌细胞侵袭和细胞毒性的影响。
使用单因素方差分析进行统计分析,p值<0.05被认为具有显著差异。白色念珠菌EVs是具有双层膜的纳米颗粒,峰值尺寸为111.9和230 nm。EVs对粪肠球菌及其生物膜表现出复杂的影响;5μg/mL的EVs显示出抑制作用,而0.156μg/mL的EVs促进其生长。EVs对粪肠球菌毒力表现出持续的影响。值得注意的是,5μg/mL的EVs减少了粪肠球菌对RAW264.7细胞造成的损伤,以及粪肠球菌对巨噬细胞的侵袭能力和巨噬细胞吞噬后粪肠球菌的胞内存活能力,而0.156μg/mL的EVs则具有完全相反的效果。白色念珠菌EVs对粪肠球菌的生长和毒力具有双重影响,高浓度EVs抑制粪肠球菌的生长和毒力,而低浓度EVs则促进其生长和毒力。
这表明白色念珠菌EVs参与了真菌-细菌间的通信,可能为控制粪肠球菌提供新的策略。本研究首次系统揭示了白色念珠菌EVs在调控粪肠球菌致病性中的双重作用,为理解真菌-细菌跨界互作提供了新的分子机制。高浓度EVs(5μg/mL)展现出的抑制作用提示其可能作为控制粪肠球菌感染的新型制剂,为PTED的防治提供了潜在策略。未来研究将进一步解析EVs中活性成分及其作用机制,为临床干预提供理论依据。Bioscreen全自动生长曲线分析仪在本研究中的应用体现了其在高通量、实时监测、自动化操作等方面的技术优势。与传统的手工测定方法相比,该设备能够提供更连续、更精确的生长动力学数据,为微生物相互作用研究提供了强有力的技术支持。本研究通过该设备获得的可靠数据,为理解白色念珠菌与粪肠球菌之间的跨界通讯机制奠定了坚实基础。
相关新闻推荐
1、副鸡禽杆菌生长曲线测定方法:分光光度法VS菌落计数法(二)
2、新型环状阳离子多肽的从头设计及其对植物病原细菌的抑制作用(二)
3、增温和二氧化碳富集对土壤细菌的生长策略、系统发育模式的影响(二)
