2.2 LL@Fe-TA@mGN 的生长曲线测定
为了排除mGN 包埋抑制LL 生长的可能性,对比了12 h 内LL@Fe-TA@mGN 与未包埋的LL的生长曲线。由图3 可知,mGN 包埋未影响LL 的生长,为后续研究奠定了基础。
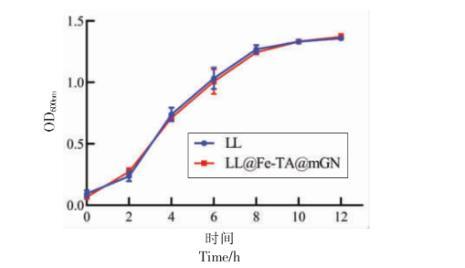
图3 LL 与LL@Fe-TA@mGN 的生长曲线
2.3 LL@Fe-TA@mGN 的微观形态分析
通过SEM 与TEM 表征可以观察到包埋前、后的LL 形态。从图4 可以发现,未包埋的LL 表面光滑,而包埋后的LL 结构完整,表面粗糙,且没有LL 暴露在外面。这一结果说明通过金属-酚醛网络结构的桥联作用,可将mGN 作为壁材有效地包埋单个LL。TEM 分析结果也证明了mGN 被黏附在单个LL 的表面。此外,SEM 与TEM 分析结果表明,包埋后的LL 粒径会发生显著变化。

图4 LL(a)与LL@Fe-TA@mGN(b)的SEM图(×30k)
图5 LL(a)与LL@Fe-TA@mGN(b)的TEM图(×30k)
2.4 LL@Fe-TA@mGN 的胃液与胆盐耐受性研究
益生菌对胃液是非常敏感的。在通过胃部环境的时候,益生菌常因受到强酸(pH≤2.5)的影响而失活,因此增强益生菌在胃部环境的抗性是其发挥生物活性的前提。如图6 所示,未包埋的LL在模拟胃液(SGF)的环境下孵育0.5 h,存活率降至39.35%;孵育1 h 后,存活率为13.00%;孵育2 h 后,LL 基本全部死亡,存活率仅有0.71%。而包埋过的LL 存活率始终高于未包埋的LL,且存在显著性差异。LL@Fe-TA@mGN 在SGF 环境下孵育0.5 h 的存活率高达68.60%,孵育1 h 后存活率变为31.79%。即使在孵育2 h 后,益生菌的存活率仍然有10.39%,是未包埋益生菌存活率的14.63倍。该结果表明,经mGN 包埋后LL 抵抗胃液的能力显著提升。
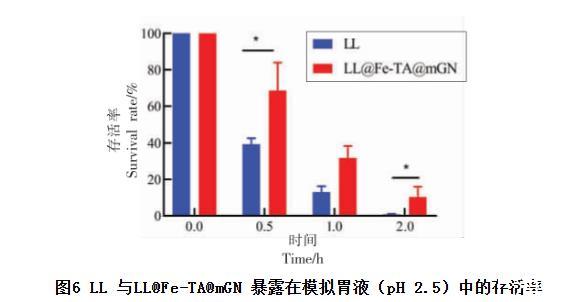
图6 LL 与LL@Fe-TA@mGN 暴露在模拟胃液(pH 2.5)中的存活率
注:*.P <0.05。
人们在摄入食物时,十二指肠会分泌荷尔蒙,从而刺激胆囊收缩。胆汁在胆囊收缩的影响下通过胆管进入肠道。胆盐承担了胆汁的主要消化功能,由于胆盐在人体中易形成胶束,且肠道-肝脏循环系统的存在,使得每个胆盐分子在消化阶段能够被重复利用多次,这极大地影响了益生菌的活性。因此为了能够以一定的数量定殖于肠道并发挥生物活性,益生菌还需要抵抗胆盐的降解。由图7 可知,包埋后的LL 抵抗胆盐的能力显著提升,即使在胆盐中孵育2 h,活菌数量仍然有42.66%,相对于未包埋的LL 的存活率(22.01%)具有显著性差异。以上结果表明,mGN 赋予了LL较好的抗胆盐性能。
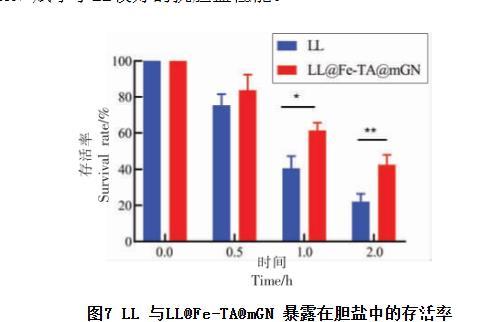
图7 LL 与LL@Fe-TA@mGN 暴露在胆盐中的存活率
注:*.P <0.05;**.P <0.01。
2.5 LL@Fe-TA@mGN 的体内滞留成像
肠道蠕动加速了益生菌的排泄。减缓益生菌被排出体外的速度有利于益生菌在肠道的定殖。mGN 作为一种益生元,可被肠道中的肠道菌群代谢形成短链脂肪酸。随着最外层mGN 的破坏,Fe-TA 结构随之暴露。鉴于金属-酚醛网络结构较强的黏附能力,进一步探究了LL@Fe-TA@mGN 在体内的滞留能力。使用Cy5 对LL 进行标记,并构建Cy5 标记的LL@Fe-TA@mGN。用标记后的LL 或者LL@Fe-TA@mGN 灌胃小鼠,分别在4 h和8 h 后进行活体成像,结果如图8 所示。由图8可知,给药4 h 后,被灌胃LL 组的小鼠的体内荧光强度显著弱于灌胃LL@Fe-TA@mGN 的小鼠,说明LL 被大量的代谢排出体外。即使在灌胃8 h后,LL@Fe-TA@mGN 在小鼠体内仍然保持较高的益生菌数量,而LL 基本被排出体外。以上结果表明,LL@Fe-TA@mGN 具有更好的体内滞留能力。
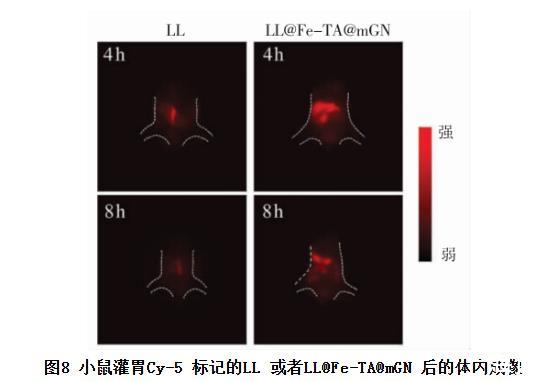
图8 小鼠灌胃Cy-5 标记的LL 或者LL@Fe-TA@mGN 后的体内成像
3 结论
本文以羧甲基化β-葡聚糖为壁材,通过金属-酚醛网络结构的桥联作用,可实现对单个乳酸乳球菌的完整包埋。这种包埋方法简单、快速,在不改变乳酸乳球菌自身结构的情况下,可显著提升乳酸乳球菌的抗胃液与抗胆盐能力,并延长其在体内的滞留,从而帮助乳酸乳球菌在体内更好地繁殖。研究结果为乳酸乳球菌包埋体系的构建提供了新思路,并为提高乳酸乳球菌在胃肠道的活性提供了理论依据。
相关新闻推荐
1、大肠埃希菌的噬菌体DK-13生物学特性及对污染猪肉的杀菌作用(三)
2、三甲胺和三甲胺N-氧化物可使深海细菌具有耐受深海高静水压的能力
