2结果与分析
2.1 APP鉴定及血清型分型
将临床分离到的疑似APP菌株,用APP特异性基因apxIV片段的引物进行PCR扩增,鉴定出APP菌株共53株。采用针对APP 1~15血清型特异性基因的引物进行基因扩增,结果显示,本研究鉴定出APP菌株血清型1型25株(959 bp)、7型20株(601 bp)、5型3株(825 bp)、15型4株(1 595 bp)和8型1株(1 157 bp)(图1A)。对菌株来源分析发现,本研究鉴定的53株临床主要来自于江西、云南及甘肃等地区(图1B),江西地区以7型为主、云南甘肃都以1型为主,3株血清型5型来源于江西和云南,4株血清型15型来源于甘肃、江西和陕西。所有菌株血清型以1型和7型为主,5型和15型次之,8型相对较少。
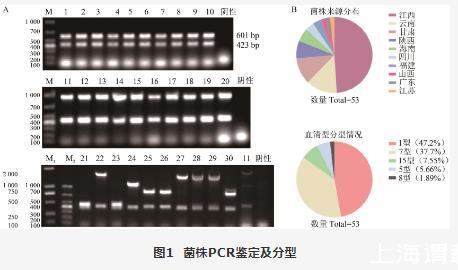
图1菌株PCR鉴定及分型
A:血清分型鉴定;B:菌株来源分布及血清型分型情况。
2.2菌株生物学特性检测
2.2.1生长曲线和溶血活性测定
为测定临床APP菌株各个血清型生长趋势及规律,本研究通过测定细菌不同时间的OD600nm值,绘制生长曲线。如图2A所示,各血清型菌株均能在培养基中生长良好。在2~4 h进入对数中期,10~12 h为衰亡期。其中1型菌株OD600nm最高值能达到0.5~0.8;5型菌株OD600nm最高值能达到0.3~0.4;7型菌株OD600nm最高值能达到0.4~0.6;15型菌株OD600nm最高值能达到1~1.2,15型菌株生长速度较其他血清型更快。
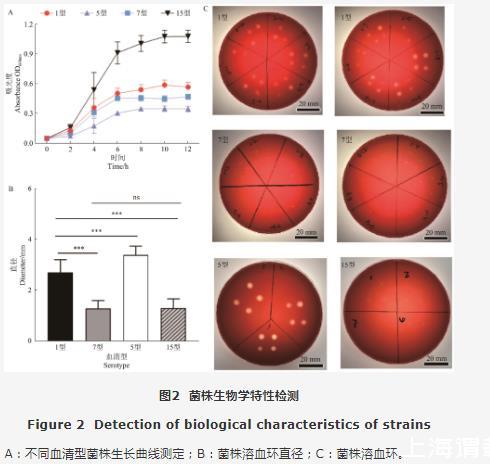
图2菌株生物学特性检测
A:不同血清型菌株生长曲线测定;B:菌株溶血环直径;C:菌株溶血环。
本研究也对不同血清型菌株的溶血活性进行了测定。如图2C所示,不同血清型菌株均能在绵羊血培养基中出现透光的溶血环,但溶血活性不同:1型菌株溶血环(2.726 mm±0.516 mm)和5型菌株溶血环(3.427 mm±0.350 mm)直径较大;7型菌株(1.316 mm±0.314 mm)和15型菌株(1.337 mm±0.363 mm)溶血环直径较小(图2B和图2C)。这与前期报道一致,4种血清型菌株均含有溶血活性的毒素ApxII,而1型、5型菌株含有溶血活性更强的毒素ApxI,因此能形成更大的溶血环。
2.2.2耐药性情况检测
根据2020版美国临床和实验室标准协会(CLSI)中的标准,采用流感嗜血杆菌和副流感嗜血杆菌标准对MIC结果进行分析,其中多西环素参考四环素类药物标准(MIC≤2μg/mL为敏感,MIC≥8μg/mL为耐药)、氟苯尼考参考氯霉素标准(MIC≤2μg/mL为敏感,MIC≥8μg/mL为耐药)。结果如表3所示,所有血清型对多西环素均较为敏感,但是7型菌株中有10%为耐药菌株。对于氟苯尼考,1型临床分离株对敏感性普遍较低,耐药率高达88%,5型和15型对氟苯尼考较为敏感,而7型存在40%的耐药菌株。本研究也对没有参考标准的抗生素按MIC≤2μg/mL为敏感,MIC≥8μg/mL为耐药进行分析。发现对于磺胺二甲嘧啶和泰乐菌素,临床分离菌株均不敏感。对于盐酸克林霉素和庆大霉素,临床分离株均较敏感。而值得注意的是,对于恩诺沙星、青霉素和头孢噻呋的敏感性最高。
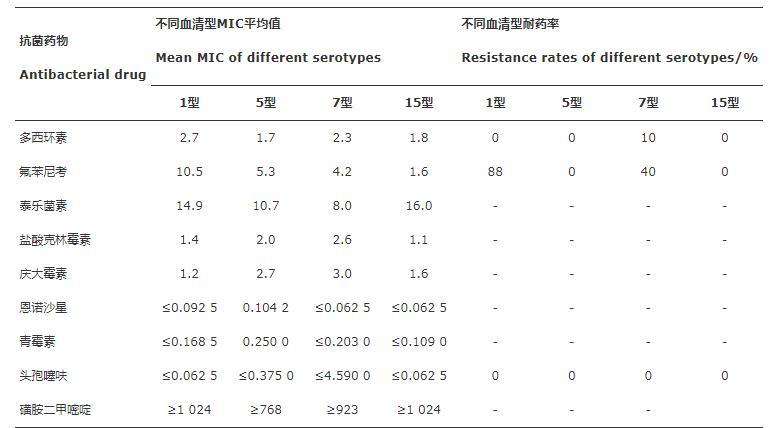
表3分离菌株对抗生素的耐药结果
2.2.3大蜡螟初筛疫苗候选菌株
为了筛选高毒力菌株,本研究首先利用大蜡螟幼虫作为动物模型进行初步筛选。通过2轮感染实验后,排除2次结果误差较大的菌株,选择死亡率大于50%且感染剂量低的菌株作为候选菌株。如图3A所示,本研究选择1型菌株(命名为1-4、3-7、6-8)和7型菌株(命名为2-6、4-10)进行后续试验。由于菌株数量较少,5型(命名为4-3、4-9、7-2)和15型(命名为1-5、5-5、5-11、6-9)直接进行后续试验。
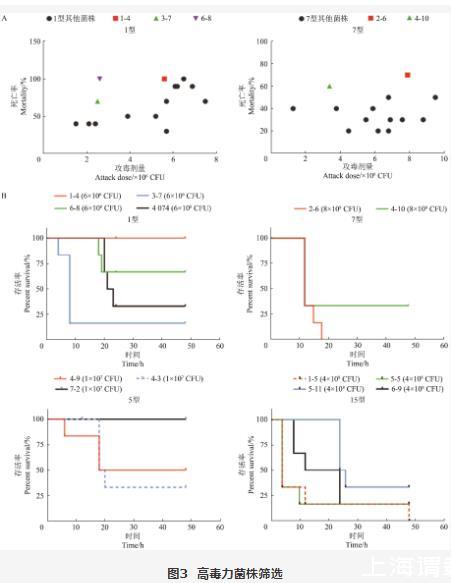
图3高毒力菌株筛选
A:大蜡螟模型初筛血清1型和7型高毒力菌株;B:各血清型菌株对小鼠的存活率。
2.2.4小鼠筛选高毒力疫苗候选菌株
小鼠毒力试验结果显示,血清型1型菌株3-7、5型菌株4-3、7型菌株2-6、15型菌株1-5对小鼠的致死率较高,分别为83.33%、66.67%、100%和100%,选为高毒力疫苗候选菌株用于后续试验。
2.3疫苗候选菌株免疫效果评价
2.3.1疫苗候选菌株LD50测定
测定疫苗候选菌株LD50,为后续的疫苗免疫和攻毒试验剂量的提供参考。利用改良寇氏计算法得出血清型1型、5型、7型和15型菌株对Balb/c小鼠的LD50分别为2×106、1×107、6.3×107和2×108 CFU。
2.3.2疫苗抗体水平检测及保护率测定
制备筛选获得临床分离株的灭活疫苗,以商品化疫苗作为对照对小鼠进行免疫。对于血清型1型菌株,临床分离株免疫剂量不到商品化疫苗中1型菌株的1/5,保护效果却与商品化疫苗一致,均达到100%,且二免后诱导抗体水平相似,表明该1型分离株具有疫苗开发潜力(图4A)。对于血清型5型临床菌株,免疫剂量不到商品化疫苗中5型菌株的1/5,二免后诱导抗体水平与商品化疫苗相似,但攻毒后小鼠存活率(83.3%)低于商品化疫苗免疫组(100%)(图4B)。对于血清型7型临床菌株,免疫剂量约为商品化疫苗中7型菌株的10倍,二免后诱导抗体水平显著高于商品化疫苗,但攻毒后小鼠存活率(50%)低于商品化疫苗免疫组(66.7%)(图4C)。如图4D所示,商品化疫苗中没有15型菌株,二免后商品化疫苗仍然能够诱导一定的15型菌株抗体,但其抗体水平显著低于临床菌株,攻毒后,临床菌株组小鼠存活率(66.7%)高于商品化疫苗免疫组(50%)(图4D)。
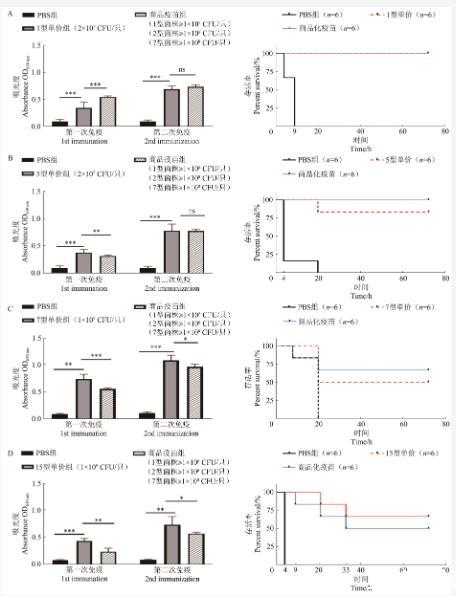
图4单价灭活疫苗免疫效果评价
A:1型单价疫苗组抗体水平测定及保护率评价;B:5型单价疫苗组抗体水平测定及保护率评价;C:7型抗体水平测定及保护率评价;D:15型单价疫苗组抗体水平测定及保护率评价。
2.3.3疫苗候选菌株稳定性实验
为了研究疫苗候选菌株的稳定性,本研究将菌株在体外连续传代30次后,分别选取候选菌株的10代、20代、30代菌株以致死剂量感染小鼠,每组6只,观察小鼠存活情况。结果显示,血清型1型菌株攻毒后,0代、10代、20代和30代菌株对小鼠的致死率分别为100%、100%、100%和50%。血清型5型菌株攻毒后,0代、10代、20代和30代菌株对小鼠的致死率分别为50%、83.3%、50%和50%。血清型7型菌株攻毒后,0代、10代、20代和30代菌株对小鼠的致死率分别为100%、100%、100%和50%。血清型15型菌株攻毒后,0代、10代、20代和30代菌株对小鼠的致死率分别为83.3%、50%、83.3%和50%(图5)。结果可见,所有菌株在传代20代内都表现出较高毒力。
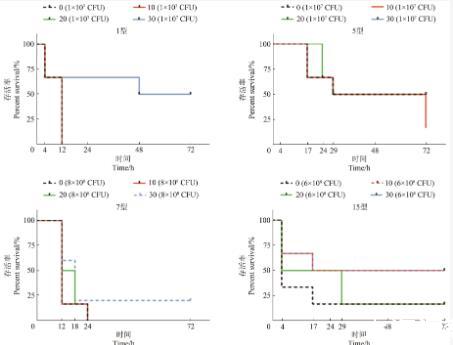
图5候选菌株传代稳定性测试
相关新闻推荐
1、光合细菌怎么培养?光合细菌的培养条件与生产工艺、颜色变化
2、基于MALDI-TOF微生物质谱菌种快速鉴定技术,助力微生物鉴定和污染溯源调查
3、基于革兰氏阳性菌生长曲线等指标评价纤维素基抑菌材料L-Met改性MCC(M-MCC)抑菌效果(四)
