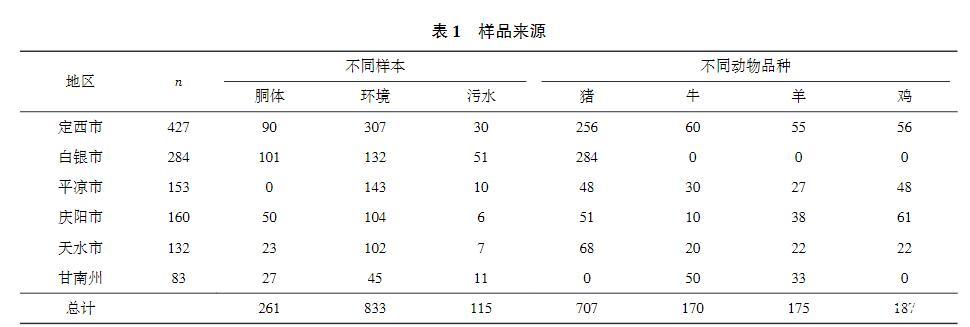
菌株分离鉴定:参考国标GB 4789.30-2016方法进行分离培养。样品经LB1增菌(30℃,22-26h),转接LB2增菌(30℃,22-26h)。取增菌液划线接种于PALCAM培养基和LM显色培养基上(37℃,24-48h)。挑取可疑菌落接种TSB培养基过夜培养后,提取DNA。以DNA为模板,先用李斯特菌属通用引物Prs进行PCR扩增(预期片段370bp),再将PCR阳性产物用LM特异性引物Lom2234进行PCR扩增(预期片段420bp),经琼脂糖凝胶电泳鉴定确认LM。ATCC19115作为阳性对照,ddH2O作为阴性对照。引物序列详见表2。

血清型鉴定:使用日本生物研究所的LM诊断血清试剂盒鉴定分离株血清型。O抗原鉴定:细菌悬液热处理后与相应血清在载玻片上反应观察凝集。H抗原鉴定:使用克雷基氏试管法筛选运动性强的菌株,其福尔马林灭活液与相应血清在试管中于51℃水浴1h后观察凝集。根据阳性结果判定血清型。
多位点序列分型(MLST):根据巴斯德研究所网站(网址略)提供的7个管家基因(abcZ,bglA,cat,dapE,dat,ldh,lhkA)设计引物(引物序列详见表3)。提取分离株DNA作为模板进行PCR扩增。PCR产物测序,测序结果在巴斯德研究所MLST数据库中进行比对以确定菌株序列型(ST)和克隆群(CC)。

细菌生长曲线测定:从不同来源、血清型及ST型的LM分离株中选取25株,及参考株ATCC19115进行测定。将过夜培养的菌液OD600nm值调节为0.2,转接于新鲜BHI培养基中,37℃摇床培养。从3h开始每小时测定菌液OD600nm值,绘制生长曲线。每组3个重复。
微孔板测定细菌生物被膜形成能力:选取25株LM分离株及参考株ATCC19115进行测定。将过夜培养的菌液浓度调节至OD600nm值为0.2,再稀释100倍加入96孔细胞板(200μL/孔),每株菌6个重复,阴性对照为BHI培养基。37℃静置培养48h。弃去培养物,PBS清洗3次去除浮游菌。200μL甲醇固定20min,干燥后200μL结晶紫染色10min,蒸馏水清洗干燥,200μL 90%酒精脱色10min,测定OD595nm值。
屠宰场消毒剂对分离菌株的最小抑菌浓度(MIC)测定:选取25株LM分离株及参考株ATCC19115进行测定。将过夜培养的菌液浓度调整至OD600nm值为1.0,再用BHI培养基稀释1000倍备用。选用0.2%甲醛溶液、0.2%苯扎溴铵、0.5%碘溶液和2%氢氧化钠4种消毒剂。将消毒剂在Eppendorf管中用蒸馏水连续2倍比稀释。不同稀释度的消毒剂(100μL/孔)与稀释菌液(100μL/孔)加入96孔板混匀。37℃培养20-24h后测定OD600nm值。MIC定义为完全抑制细菌生长的最低药物浓度。
结果
单增李斯特菌PCR鉴定:所有分离株均经Prs引物扩增得到约370bp片段(图1A),Lom2234引物扩增得到约420bp片段(图1B),确认为LM。
菌株检出情况:从1239份样品中共分离出LM 58株,总检出率为4.68%。地区分布:天水市检出13株(9.85%),定西市检出38株(8.90%),庆阳市检出6株(3.75%),甘南检出1株(1.20%),白银市和平凉市未检出。动物种类来源:猪样品检出26株(3.68%),牛样品检出12株(7.05%),羊样品检出9株(6.28%),鸡样品检出8株(4.28%)。样品类型来源:胴体样品检出14株(7.33%),器具环境样品检出40株(4.80%),污水样品检出4株(3.48%)。菌株编号依据来源地(定西:DX2023LM01-38;庆阳:QY2023LM01-06;天水:TS2023LM01-13;甘南:GN2023LM01)。
