1材料与方法
1.1材料
1.1.1菌株、质粒和引物本研究用到的菌株、质粒和引物分别见表1和表2。大肠杆菌DH5α用于质粒载体的构建和扩增,并用作lac Z基因的供体;酵母菌株W303-1A和An-a用作亲本菌株,酵母菌株WC用作特定核酸序列片段的供体。菌株WC在前期工作中从菌株W303-1A构建,其染色体LEU2基因ORF内第443到第445位的三个碱基被删除,同时代替插入了片段UPRE-mCherry。此片段全长1 215bp,含有如下元件:Sal I酶切位点;26bp未折叠蛋白质应答元件(unfolded protein response element,UPRE)碱基序列5'-AGGAACTGGACAGCGTGTCGAAAAAG-3';CYC1基因起始密码子上游250bp序列(简称Pcyc1);711bp mCherry ORF序列;216bp ADH I基因终止子序列(简称TadhI);BamH I酶切位点。当将此片段中基因mCherry替换为lac Z时,片段名称相应变为UPRE-lac Z。
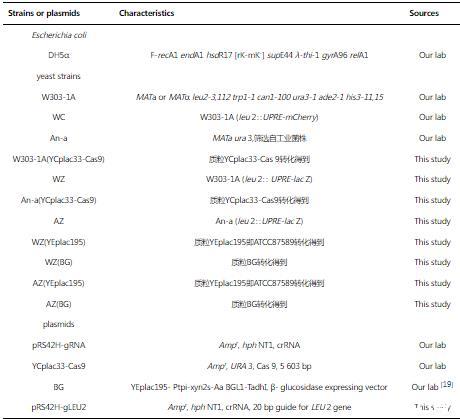
表1实验所用菌株和质粒

表2实验所用引物
1.1.2培养基和生长条件大肠杆菌用培养基和培养条件:(1)Luria-Bertani(LB)培养基(g/L):酵母抽提物5,胰化蛋白胨10,NaCl 10,pH 7.0,固体培养基则还需添加琼脂粉15,用于转化子筛选时添加氨苄青霉素至终浓度100mg/L(简称为LB+Ap100平板);(2)培养条件:固体为37℃培养箱倒置;液体为37℃、240r/min。
酵母用培养基和培养条件:培养基有:(1)YPD培养基、CMG完全基本培养基、筛选用培养基CMG-URA、CMG-URA+HyB和反选用5'-乳清酸(简称5'-FOA)平板,均参见陆海燕等人文献[20],HyB为潮霉素B的简称;(2)YPC培养基:碳源为纤维二糖,余同YPD;(3)衣霉素诱导剂显色筛选平板YPD+Tm+X-Gal:在YPD固体培养基中添加衣霉素(tunicamycin,Tm),使其终浓度为1μg/ml;添加5-溴-4-氯-3-吲哚-β-D-半乳糖苷(X-gal),使其终浓度为40μg/ml。培养条件:固体为30℃培养箱倒置;液体为30℃、220r/min。
1.1.3主要试剂和仪器主要试剂:鲑鱼精DNA购自美国Clontech公司,LiAC、PEG4000购自美国Sigma公司,内切酶、DNA Marker、Taq等工具酶购自大连Takara公司,其余实验所需试剂均购自上海生工技术有限公司。琼脂糖凝胶片段回收试剂盒以及质粒抽提试剂盒购自美国Omega公司。无缝重组试剂盒购自诺唯赞公司。引物合成及序列测定由北京奥科生物技术公司完成。主要仪器有:紫外分光光度计(美国Unico公司),PCR仪(德国Biometra公司),恒温培养箱(德国Memmert公司)。
1.2质粒构建
以pRS42H-gRNA为出发材料构建得到pRS42H-gLEU2(见表1)的流程,概述如下:(1)制备pRS42H-gRNA PCR产物:以质粒pRS42H-gRNA的Not I酶切线性化片段为PCR扩增模板,使用引物对P1和P2(见表2)进行扩增,反应条件为:95℃5min,94℃30sec,52℃30sec,72℃5min,循环30次,末次72℃延伸10min;(2)连接和转化:将(1)所得片段使用诺唯赞公司的无缝重组试剂盒按说明书进行首尾连接,然后转化大肠杆菌DH5α感受态细胞,用LB+Amp100平板进行筛选;(3)转化子鉴定:LB+Amp100平板生长菌落接种LB+Amp100液体培养基过夜培养,用CTAB法提取质粒,对质粒提取物进行酶切鉴定和测序。
1.3 Donor DNA合成
分别以表1中菌株WC、DH5α和WC基因组DNA为模板,使用表2所示三对引物对P3/P4、P5/P6、P7/P8进行三个片段的扩增:含元件H1和UPRE的PCR1片段;含元件LacZ ORF的PCR3片段;含元件TadhI和H2的PCR2片段。分别以PCR1和PCR3为模板,使用引物对P3、P6进行第一轮重叠交叉延伸PCR反应,产物命名为PCR13,预期长度3 439bp;以PCR13和PCR2为模板,使用引物对P3、P8进行第二轮重叠交叉延伸PCR反应,产物命名为PCR123,预期长度3 721bp。PCR反应条件为:95℃5min,94℃30sec,(52~56)℃30sec,72℃(1~5)min,循环30次,末次72℃延伸10min。
1.4酿酒酵母感受态细胞的制备及转化
按文献中的方法制备感受态细胞并进行转化、筛选和鉴定,具体如下:(1)YCplac33-Cas9转化:表1质粒YCplac33-Cas9转化菌株W303-1A和An-a感受态细胞,利用CM'G-URA平板进行筛选,得到W303-1A(YCplac33-Cas9)和An-a(YCplac33-Cas9);(2)指示菌株构建:制备菌株W303-1A(YCplac33-Cas9)和An-a(YCplac33-Cas9)感受态细胞,将质粒pRS42H-gLEU2和donor DNA片段共转化,利用(CM'G-URA+HyB)平板筛选,生长菌落复制到(CM'G-URA+HyB)平板复筛,进一步点接到平板YPD+Tm+X-Gal进行显色,呈现蓝色者接种液体培养、提取染色体DNA,然后进行菌落PCR鉴定及PCR产物测序。PCR鉴定引物对为P9、P10。测序为预期序列者进一步进行5'-FOA平板反选,以筛选得到质粒YCplac33-Cas9丢失的阳性转化子菌株。
质粒BG的转化方法同YCplac33-Cas9转化。
1.5生长评价
挑取固体培养基平板上新鲜生长的菌落,接入装有5ml YPD培养液的试管中,30℃、220r/min培养过夜,转接进行二次液体培养,所得菌液为种子液;接种到装有50ml YPD培养液的250ml摇瓶中,控制起始OD600=~0.2,30℃、220r/min培养,定期取样测定OD600值,绘制生长曲线。
当碳源为纤维二糖时,试管种子液培养改为CMG-URA培养基,而摇瓶培养基改为YPC,定期取样测定OD600值和β-葡萄糖苷酶及β-半乳糖苷酶酶活,其余类上。
1.6对酸醇的UPR信号响应评价
将菌株W303-1A(leu 2∷UPRE-lacZ)和An-a(leu 2∷UPRE-lacZ)经过两次YPD液体培养基活化,接种于装有105ml YPD培养基的500ml摇瓶中,控制初始OD600≥0.2,30℃、220r/min条件下培养,当OD600=2时停止培养,分别分装到5个100ml摇瓶中,每瓶菌液20ml,添加不同物质;考虑到乙醇容易挥发,添加乙醇后的摇瓶,统一用美国Parafilm封口膜封上数层,于30℃、150r/min条件下限氧培养;定期取样测定OD600和β-半乳糖苷酶即Lac Z的比酶活值。
1.7β-半乳糖苷酶和β-葡萄糖苷酶酶活测定
β-半乳糖苷酶酶活测定:“技术和方案7酵母β-半乳糖苷酶的测定”方法进行细胞裂解和粗提物制备、酶活测定;粗提物的蛋白质含量测定使用北京天根公司Bradford蛋白质定量试剂盒,操作按试剂盒说明书操作指南进行。酶活单位U定义为:在测定条件下,1min内水解产生1nmol ONP所需的酶量;粗酶液比酶活定义为:U/mg蛋白质(nmol ONP/min/mg蛋白质)。
β-葡萄糖苷酶酶活测定:参见文献。
需要说明的是:上述1.5到1.7的测定均至少设两次重复,结果里使用典型的、有代表性的数据。
相关新闻推荐
1、应用Bioscreen生长曲线分析仪构建温度对嗜热脂肪乳杆菌生长影响的预测模型
