石墨烯在医疗行业的应用具有巨大潜力,石墨烯具有优异的导电性、导热性、机械强度和生物相容性,可以用于制备医用材料,如人工关节、骨修复材料、人工心脏瓣膜等。石墨烯可以作为药物载体,通过其大表面积和高载药能力,可以有效地将药物载运到靶细胞或组织,提高药物的生物利用度和疗效,用于治疗癌症、炎症等疾病。石墨烯具有高灵敏度和快速响应的特性,可以用于制备生物传感器,用于检测生物分子、细胞、蛋白质等,有助于早期疾病诊断和监测。石墨烯可以用于制备医疗设备,如医用电极、心脏起搏器、神经电刺激器等,具有优异的导电性和生物相容性,有助于提高设备的性能和安全性。石墨烯可以促进伤口愈合,具有抗菌、抗炎和促进细胞生长的作用,可以用于制备敷料、药膏等,加速伤口愈合过程。
石墨烯在医疗行业的应用具有可观的前景,可以为医疗器械、药物传递、生物传感器等领域带来创新和突破,提高医疗水平和治疗效果。尽管石墨烯在医疗领域有着广泛的应用前景,但其安全性和生物相容性仍然是需要重点关注和研究的方面。在将石墨烯应用于医疗器械、药物传递、生物传感器等领域之前,需要进行充分的安全性评估和生物相容性测试,确保其对人体没有毒性和副作用。
石墨烯的改性方法,包括有以下步骤:
步骤(1),制备氧化石墨烯;
氧化石墨烯(GO)的制备方法一般分为:Brodie法,Standenmaier法,电化学法以及Hummers法,目前大多采用Hummers法经强酸氧化制备而成,GO表面具有大量的含氧基团,具有良好的亲水性能和较大的比表面积,能够用来强化材料的亲水性能和结构稳定性,也可以在水中和其他溶剂形成悬浮液,易于与有机小分子物质、聚合物等通过共价或者非共价的方式相互作用形成改性的氧化石墨烯。氧化石墨烯(GO)是石墨烯的前体,在药物传递,生物传感,细胞成像和抗菌表面等生物医学领域具有巨大的潜力。
氧化石墨烯在生物体中含有一定的毒性,因此想要使氧化石墨烯应用于生物体内,就必须对氧化石墨烯的生物相容性进行改善。评价一种材料的生物相容性要遵循生物安全性和生物功能性两个原则,既要保证该材料在生物体内没有毒性,又要使生物材料在特定的环境中发挥出其特有的潜在功能。
步骤(2),氧化石墨烯改性为L-半胱氨酸对氧化石墨烯
使用L-半胱氨酸作为还原剂,对氧化石墨烯(GO)进行表面改性,还原GO为L-半胱氨酸对氧化石墨烯,其原理是利用L-半胱氨酸中的硫醇基团与GO中游离的羟基和羧基发生化学反应,形成无毒和无害的产物水分子。
L-半胱氨酸作为一种常见的氨基酸,其表面含有氨基,而GO中含有羰基,L-半胱氨酸中的氨基会与GO中的羰基进行缩合反应。
首先取30mg/ml的氧化石墨烯(GO)5ml配置成氧化石墨烯(GO)稀溶液,超声30min。取定量氢氧化钠,配置成50ml的0.2mol/L的氢氧化钠溶液。称取0.28g的L-半胱氨酸,溶解于50ml0.2mol/L的氢氧化钠溶液中,待L-半胱氨酸颗粒溶解后,将超声后的氧化石墨烯(GO)溶液引入,加热至55℃,进行72h的快速搅拌。72h后对制备的L-半胱氨酸对氧化石墨烯(L-GO)进行高速离心,用去离子水进行洗涤去除溶液中的少许杂质。
L-半胱氨酸为生物体中一种常见的氨基酸,为含硫α-氨基酸的一种,这种L-半胱氨酸又称半胱氨酸,是一种人体非必需氨基酸,是蛋白质的组成单位,是生命的物质基础;L-半胱氨酸与胱氨酸关系密切,两分子的半胱氨酸组成一分子胱氨酸,这两种都是含硫的氨基酸,对皮肤的形成与解毒有重要作用。
L-半胱氨酸在生物体内有抱合作用,对范围广泛的毒物具有清毒解毒作用,如甲醛、乙醛、酒精、氯仿等;L-半胱氨酸是蛋白质肽链中的α-氨基酸,能与蛋白质相互作用形成巯-巯桥键,将肽链连接起来,使蛋白质具有立体网状结构,L-半胱氨酸含量越高蛋白质会越坚硬;L-半胱氨酸在皮肤蛋白的角蛋白生成中维持重要的巯基酶的活性,并且维持皮肤正常的代谢,可治疗广泛的皮肤病,如荨麻疹、湿疹、药疹等。
由于L-半胱氨酸分子中具有活泼的巯基,具有很多重要的生理功能,如增强肝功能、解除苯中毒、防止食品氧化等,因此被广泛应用于医药、食品和化妆品等方面。
L-半胱氨酸作为一种常见氨基酸,可改性氧化石墨烯降低毒性,提高生物相容性,可在体内进行新陈代谢,有利于细胞的黏附及生长。
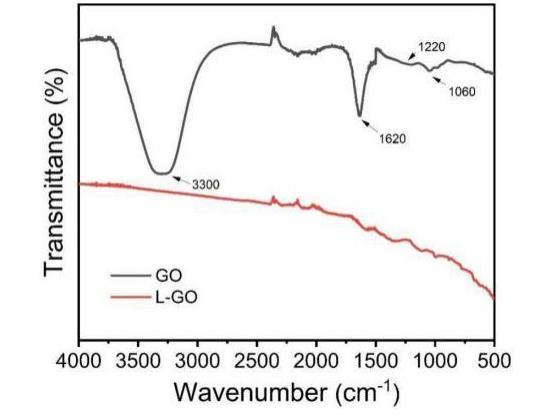
使用L-半胱氨酸对氧化石墨烯(GO)进行表面改性后,通过FTIR表征L-半胱氨酸及氧化石墨烯,来判定氧化石墨烯(GO)是否改性成功。
将GO与L-GO的红外进行比较可以清晰地发现,GO在3300cm-1附近观察到吸收峰O-H伸缩振动,C=O在1724cm-1处来自羧基,C-O烷氧基在1060cm-1,C-O-C环氧基团在1220cm-1,C=C在1620cm-1处来自芳族结构的振动。而L-GO在这几处都不存在明显的吸收峰,说明L-半胱氨酸成功的与GO表面的基团进行了化学反应。
步骤(3)L-半胱氨酸对氧化石墨烯的细胞毒性与相容性实验

通过细胞毒性分析能更宏观的表现出改性前后石墨烯的细胞毒性,通过对死活细胞进行荧光染色,使用共聚焦显微镜来拍摄照片。图4所示为经过细胞培养皿培养出来的细胞,图4a为经过CMCS/CMC凝胶海绵的浸出液培养出的细胞,可以看出染色后都是绿色细胞,为活细胞,说明该凝胶海绵具有无毒性。图4b为经过CMCS-CMC/GO凝胶海绵的浸出液培养出来的细胞,可以看出绿色细胞明显大幅度减少,黄细胞明显增多(死细胞),说明该凝胶海绵具有相应的毒性。图4c为经过CMCS-CMC/L-GO凝胶海绵的浸出液培养出来的细胞,与图4b相比绿色细胞有明显上升,黄色细胞有降低趋势,这说明该凝胶海绵的细胞毒性要弱于图4b组。这组死活细胞实验直接证明了L-半胱氨酸改性后的凝胶海绵的生物相容性要有所增强,L-半胱氨酸对GO的改性是成功的。
通过细胞死活实验来观察L-GO与GO的毒性大小,由细胞增殖曲线可以看出L-GO/CMCS凝胶海绵的生物相容性要远高于CMCS/GO凝胶海绵,进而说明L-半胱氨酸对GO的改性降低了GO的毒性,提升了生物相容性。
步骤(4)L-半胱氨酸对氧化石墨烯的抗菌性实验;
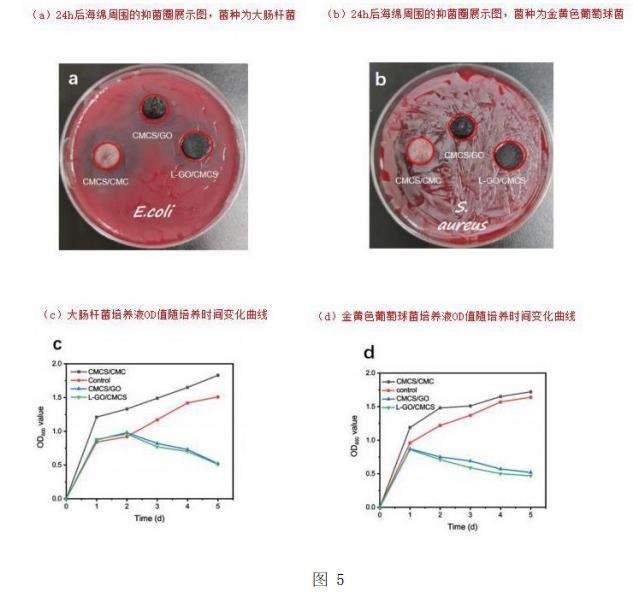
本实验的革兰氏阳性测试菌种选用的是金黄色葡萄球菌Staphylococcusaureus,革兰氏阴性测试菌种采用的是大肠杆菌Escherichiacoli。通过抑菌环实验测得各样品的抑菌环直径后对其进行细菌定量计数实验,并通过不同时间段的OD值绘制生长曲线。图5所示,a和b分别是大肠杆菌培养皿和金黄色葡萄球菌培养皿,而c和d分别代表大肠杆菌OD值和金黄色葡萄球菌OD值。OD值越大,透光率越小,细菌越多。c图和d图显示了三组凝胶海绵和一组对照实验的OD值,可以看到在最开始的一天时间内,四组实验测试的OD值均呈上升趋势,而CMCS/CMC凝胶海绵实验的OD值最高,空白对照次之,这表明在开始的一天内,四组实验的抗菌效果都很弱,但是CMCS/GO海绵和L-GO/CMCS海绵的抗菌效果相比于其他两组较强。在第二天至第五天,CMCS/CMC凝胶海绵和空白对照实验的OD值仍然上升,细菌持续增长,但是在c图大肠杆菌的实验中,CMCS/GO海绵与L-GO/CMCS海绵第一天与第二天的区间里细菌数量上升减缓,而从第二天以后OD值下降,第五天均降至0.5附近,表明这两组海绵的抗菌作用显著。在d图金黄色葡萄球菌的实验中,从第一天以后CMCS/CMC和L-GO/CMCS凝胶海绵的OD值均极速下降至0.5附近,这表明这两组海绵具有优异的抗菌性能,与另外两组形成鲜明反差,且L-半胱氨酸对GO的改性并没有破坏GO原有的抗菌性。
大肠杆菌和金黄色葡萄球菌的抗菌实验验证了CMCS/CMC凝胶海绵、CMCS/GO凝胶海绵和L-GO/CMCS凝胶海绵的抗菌性,通过OD曲线可以看出GO与L-GO均具有优异的抗菌性,且L-半胱氨酸改性GO后不会破坏其抗菌结构。
相关新闻推荐
1、中草药大青叶对酒曲发酵过程酒曲理化参数及微生物活性的影响(二)
2、基于低生物量微生物富集方法观察ICU患者下呼吸道微生物组的功能和进化动态
