为深入学习细菌生长曲线测定方法,并使其在教学、科研和生产中得到更好应用,以实验室分离菌株为研究对象,以大肠埃希菌生长曲线的测定为实验方法,并对该方法的应用进行了研究并提出改进方案。研究结果表明,采用上述方法仅测出2株葡萄球菌属菌株的生长曲线,采取增加溶氧量、单瓶培养及取样后立即测定,得到3株芽胞杆菌属菌株的生长曲线,而对产色素的考克氏菌属菌株宜采用平板菌落计数的方法进行生长曲线的绘制。不同菌属菌株生长曲线的测定要根据实际情况选择合适方法,测定过程要防止低温保存对菌液光密度的影响。
微生物学实验技术和方法是微生物学建立和发展的基础,各学科的交叉和渗透极大地丰富了微生物学实验技术的内容,并将其推向一个新的发展阶段。微生物学是一门内容丰富、与人类关系密切、极富探索性和实用性的学科,具有很强的实践性和应用性。近年来微生物学实验技术和方法逐渐渗透到食品工业[1]、发酵工业[2]、生物工程[3]和环境保护[4]等领域,以实现利用和保护有益微生物、控制和消灭有害微生物的目的。微生物的生长繁殖有一定规律性,可分为延迟期、对数期、稳定期和衰亡期4个阶段[5],其中延迟期和稳定期具有重要的实际应用价值,尤其在食品工业和发酵工业中。延迟期的长短受各种外界因素的影响,包括氧气、温度、湿度等。人们可以根据控制外界环境条件来延长延迟期的时间,一旦度过延迟期,即标志着食品保质期的结束[6]。稳定期特点是菌体繁殖速度和生理活性开始下降,但培养基中的代谢产物却在这段时间得到大量积累,生产上常掌握这一特点以得到大量代谢产物。例如,酱油生产中制曲目的是为了得到大量的酶,而米曲霉所分泌的代谢产物中蛋白酶和淀粉酶均在菌体进入衰老期前活力最高,根据这一特点来确定出曲时间[7]。在医学上,根据微生物生长曲线,选择恰当时间转种培养(对数期或稳定期)以提高阳性菌检出率[8-9]。另外,微生物生长曲线在废水治理中也具有重要的实践指导意义,通过生长曲线的形态为处理工艺的改进提供参考[10]。大肠埃希菌生长曲线的测定在大多数微生物学实验教材中有介绍[11-14],且采用基本相同的实验方案。然而在实际应用中套用大肠埃希菌生长曲线的测定方法来制作其他微生物的生长曲线,将会出现预料不到的困难和问题。
为强化该方案的应用性,以沈萍主编的《微生物学实验》第4版中大肠埃希菌生长曲线的制作为出发点,以实验室分离保存的菌株为研究对象,对该测定方法在实际应用中所出现的问题进行了讨论并提出了解决方案,以期为微生物实验教学的改进提供指导,也为在该专业和相关专业领域中的应用提供参考。
1、材料与方法
1.1材料
1.1.1菌种来源实验室分离保存的6株菌株AY2、AY7、AY9、AG4、AG13和AG18(通过分子鉴定初步判定菌株AG4、AG13和AG18为芽胞杆菌属,菌株AY2和AY7为葡萄球菌属,菌株AY9为考克氏菌属)。
1.1.2培养基牛肉膏蛋白胨培养基。
1.1.3试剂及仪器牛肉膏,蛋白胨,氯化钠均为国产分析纯试剂。分光光度计(TU-1810,北京普析通用仪器有限责任公司)、比色杯(光径为10 mm)、恒温摇床、试管、三角瓶等。
1.2方法
1.2.1常规方法参照文献[14]的方法进行。取各菌株种子液(OD600约为1),按5%接种量转接至盛有100 mL牛肉膏蛋白胨液体培养基的三角烧瓶内,混合均匀后分别取5 mL混合液放入已标记好培养时间的20支试管(15 mm×150 mm)中,硅胶塞封口,每时间点设置3次重复。将已接种的试管置摇床37℃、150 r/min振荡培养,按标记的培养时间取出试管,立即放冰箱中贮存,最后一同比浊测定其600 nm波长处的光密度值;以OD值为纵坐标,培养时间为横坐标,绘制生长曲线。
1.2.2改进方法①在常规方法基础上,采用50 mL离心管(28 mm×105 mm),封瓶膜(16 cm×16 cm)封口,以此增加培养液中的溶氧量,每时间点设置3次重复,其余操作不变。②在常规方法基础上,将菌株培养液按不同时间分别培养改为同一培养瓶连续培养,培养瓶换为500 mL三角瓶,封瓶膜封口,按不同培养时间取出培养液后立即测定OD值,每时间点设置3次重复,其余操作不变。这一做法在于增加溶氧量,单瓶培养以避免不同培养瓶中接种量的差异,取样后立即测定以避免低温保存对菌液光密度的影响。
2、结果与分析
2.1不同因素对菌株生长曲线的影响
2.1.1菌龄和接种量菌种的菌龄和接种量影响适应期的长短,以代谢活跃的对数期的“种子”接种则子代培养的适应期就短[15],而接种量低菌体生长慢适应期就长,反之接种量大菌体生长过快适应期短以至较早进入对数期[16]。有研究表明,当接种量增加至7%~10%时,菌株生长的差异不明显,接种量低于5%时发酵延缓或不发酵[17]。本研究接种量选择为5%,种子液为培养至对数期的菌液,6株菌中除了菌株AG4和菌株AY9,其余各菌株适应期均较短(图1、图2)。
2.1.2培养温度培养温度影响细胞内酶活力和细胞膜的通透性,进而影响细菌的生长繁殖。有研究表明,双歧杆菌属细菌的最适生长温度在37~42℃,菌体生长进入稳定期后OD600最大值为1.96[17-19]。温度过高或过低均不利于微生物的生长,本研究以37℃作为实验菌株的培养温度,除了菌株AY7和AY9之外,其他菌株在稳定期时OD600均接近2.0,说明37℃可能较为适合这些菌株的生长。然而不同菌属细菌及同属内不同菌株的生长最适温度可能不同,对此还有待进一步研究。
2.1.3需氧量不同菌株对氧气的需求程度是不同的,如双歧杆菌要在无氧条件下生长[17],而某些厌氧菌在微氧条件下比在完全厌氧条件下生长好[20]。本研究改进方法①中通过增加培养瓶容积以及培养液接触空气的面积以增加培养液的溶氧量,这有利于好氧菌的生长,即有利于菌株AG13和菌株AG18的生长(图2),这2株菌归属于芽胞杆菌属。由图3和图4可以看出溶氧量对菌株AG4和AY9的生长可能均有影响,而对菌株AY2和AY7的影响较小(图1)。
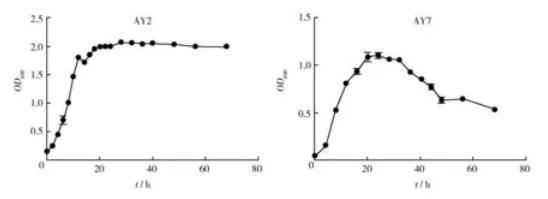
图1菌株AY2和菌株AY7的生长曲线(常规方法)Fig.1 Growth curve of strain AY2 and AY7(Conventional method)
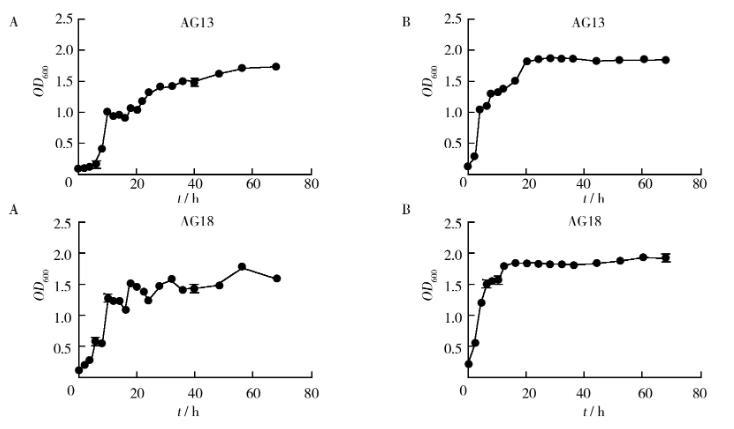
图2菌株AG13和菌株AG18的生长曲线Fig.2 Growth curve of strain AG13 and AG18A:常规方法;B:改进方法①A:Conventional method;B:Improvement method one
2.1.4检测时间常规方法测定生长曲线,是将不同培养时间菌株培养液取出放冰箱保存最后统一测定OD值,结果表明,虽然工作量减少,但冰箱保存菌株会影响菌液吸光度的测定。菌株AG4培养至24 hOD600为1.618,放入4℃冰箱保存24 h后OD600为1.268,而其他菌株OD值几乎不受影响。因此本研究改进方法②中采取取样后立即测定OD值以避免冰箱保存对细菌活力的影响。结果显示菌株AG4在前两次测定中OD值均偏低,除了冰箱保存对菌株细胞数量的影响外溶氧量也可能起到一定作用(图3),相比之下溶氧量对菌株AY9的影响可能较大(图4)。
2.1.5其他方面通过对常规方法进行改进完成了三种不同菌属菌株生长曲线的测定,从曲线形态看分两种类型,一是含有四个时期的全过程动态,二是没有衰亡期的曲线形态。仔细观察发现,菌株AY9的生长曲线不但没有出现衰亡期,反而出现稳定期后又有增长趋势(图4),可能因为菌株AY9产红色素而影响了吸光度的测定。
图3菌株AG4的生长曲线Fig.3 Growth curve of strain AG4A:常规方法;B:改进方法①;C:改进方法②,图4同A:Conventional method;B:Improvement method one;C:Improvement method two
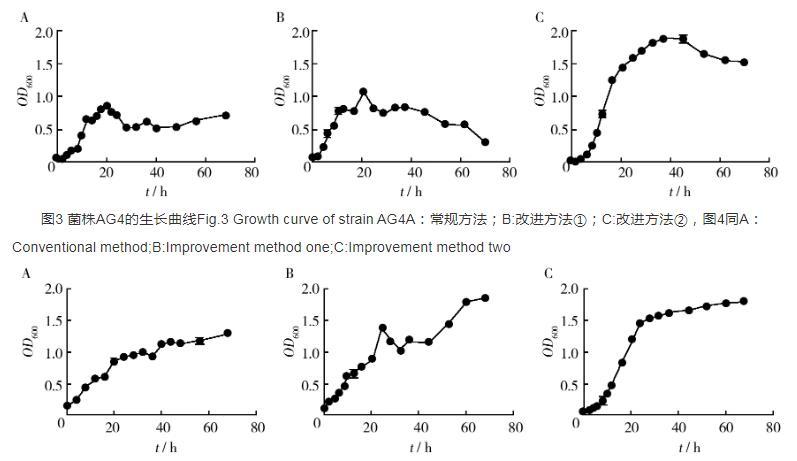
图4菌株AY9的生长曲线Fig.4 Growth curve of strain AY9
2.2不同微生物生长曲线测定方法的比较
2.2.1光电比浊法该法简便、迅速,可以连续测定,是大多数微生物学实验教材中测定大肠埃希菌生长曲线所采用的方法[11-14],很多研究工作也采取该方法进行微生物生长曲线的测定[21-26],然而此方法并不适用于所有菌株。本研究所用菌株已通过分子鉴定,初步判定分别属于芽胞杆菌属、葡萄球菌属和考克氏菌属,与大肠埃希菌是完全不同的属,但归属于葡萄球菌属的菌株AY2和菌株AY7(图1),可采用该方法进行生长曲线的测定,这两株菌可能与大肠埃希菌具有相同的生长繁殖快、易培养且在生长周期中个体形态较稳定的特点。另外光电比浊法所测光密度表示的是培养液中的总菌数,包括活菌和死菌,故衰亡期的测定不明显或没有,本研究也出现了这种情况(图2)。
2.2.2其他方法除了光电比浊法测定生长曲线外,微生物生长曲线的测定还包括平板菌落计数法和显微镜直接计数法等,均是通过细菌数量的测量来绘制生长曲线。平板菌落计数法能直接反映样品中活细胞数量,被广泛用于生物制品、食品、饮料、水以及多类产品等质量检测与控制的标准方法。显微镜直接计数法具有直观、快速、操作简单的优点,但不能区分死活细胞。由于AY9为考克氏菌属中产色素的菌株,其生长曲线在稳定期后有上升趋势(图4),故对产色素的菌株可采用平板菌落计数的方法测定生长曲线。
2.3 OD值与细胞数量之间的关系
光电比浊法测定微生物生长曲线的关键之处就是要准确测出菌悬液的OD值,且测量波长通常采用600 nm。若菌悬液浓度太大就会超出仪器的测量范围,或即使测出OD值也不能反映菌体数量。对此很多高校使用的微生物学实验指导中并未指出明确的解决办法,或者只是说明对细胞密度大的菌悬液要适当稀释,使其光密度在0.1~0.65之间即可,对如何绘制光密度-培养时间的生长曲线并未做说明。也有些实验指导书中采用稀释后测得的OD值乘以稀释倍数作为实际OD值来绘制标准曲线[12],这显然是不正确的。
有研究表明,对数期以后OD600值与菌体数量不呈线性关系,而在稳定期以前两者线性关系良好,指出菌悬液稀释倍数与实际OD600值间并不是简单的倍数关系而是乘幂关系[27-29]。马勇等[30]对高浓度培养液进行稀释使OD值在0.1~0.8之间,然后建立相关稀释倍数间的OD值回归方程,利用回归后的OD值绘制生长曲线。尽管有些菌株在对数期时所测培养液OD值可能超出0.1~0.8的范围甚至达到3.0,但OD值与菌体细胞数量之间仍然有较好的线性关系[29]。对数期的菌株细胞生长旺盛,死亡细胞很少,可直接使用实测OD值反映菌液的细胞浓度,只要所测OD值不超出仪器测量范围。本研究对高浓度培养液未做稀释也未建立相关稀释倍数间的回归方程,仍然可以得到大部分菌株的生长曲线(图1、图2、图3),尽管有些菌株生长曲线没有明显衰亡期,但这并不影响生长曲线的走向以及对菌株对数期和稳定期的判断。
3、讨论
微生物生长曲线的测定具有很强的实践性和实际应用性,无论采用哪种方法均耗时费力。由本文研究结果提出几点建议:①可采用加大接种量以缩短实验时间,使其在教学中得到开展;②选择适宜的生长曲线测定方法,如对产色素或含有其他干扰物质的微生物宜采用平板菌落计数的方法测定生长曲线;③了解菌株的最适生长条件,如温度、通气量;④以对数期的“种子”接种,接种量根据情况而定;⑤避免冰箱保存菌株培养液,建议取样后立即测定。总之要根据实际情况以及菌株各自的特点选择合适的方法进行生长曲线的测定。
相关新闻推荐
1、低浓度微酸性电解水对纯培养及海虾表面接种菌的杀菌效果以及作用机制(二)
2、鸡大肠杆菌在不同限铁培养基中的生长曲线及对空肠弯曲菌的作用(一)
