讨论
自然环境中的抗生素浓度可能会因特定环境而大不相同。例如,在污染制药行业或医院污水排放口,浓度可能达到非常高的水平(mg/ml),氟喹诺酮类药物通常达到最高水平[19,20,21],而在水生环境或土壤中,浓度通常要低得多[8]。所提供的数据表明,即使在抗生素浓度非常低的环境中,也可能发生耐药菌的维持和选择。例如,从我们的实验中获得的环丙沙星和四环素的MSC分别对应于100 pg/ml和15 ng/ml,类似于某些水生和土壤环境中的浓度[8]。因此,在相对原始环境中的动物中发现的抗生素耐药细菌的频率惊人地高[22,23,24],可以想见部分原因是亚MIC选择效应导致的富集。
这些发现也与阻力的可逆性问题高度相关。由于大多数抗生素耐药机制与适应成本有关,因此有人提出,如果抗生素选择压力降低,耐药的适应成本将允许易感细菌与耐药细菌竞争。然而,大多数可用数据表明,在社区层面上,可逆性的速度将很慢或不存在[25]。有几个因素可能导致这种不可逆性,包括不存在适应成本,通过补偿突变降低适应成本,以及赋予抗性的基因与另一个被选择基因之间的基因共选择。此外,这里观察到的亚MIC选择可能是这种长期持续耐药的重要因素,在这种情况下,环境中非常低的抗生素浓度足以通过进一步平衡耐药的适应成本来维持种群中现有的耐药细菌。这对于正常生命周期涉及土壤环境(如铜绿假单胞菌)生长或水生环境(如大肠杆菌)周期性生长的细菌病原体尤为重要。
从图2B、D和图3B、D、F和H中曲线的斜率可以推断,抗性突变的适应度成本对MSC的价值有重大影响。这一成本必须首先通过抗生素对易感细菌的负面影响来克服,然后才能选择耐药细菌,将MSC转移到更高浓度。降低这一成本将使曲线向上移动,并降低MSC。同样明显的是,突变体的抗性增加(MICsusc.和MICres.之间的差异)或者,相对于适应成本而言,耐药模式(点突变或外排泵)对MSC几乎没有影响。由于我们的数据是在特定的遗传背景下获得的,在测试的抗生素中通常会发现单点突变或缺失,因此适应度成本代表了新发耐药突变的成本。然而,在临床上发现的大多数耐药菌株中,耐药的适应成本通常通过二次突变得到补偿,而不会丧失耐药性[25]。这种适应性补偿被描述为对许多不同抗生素的耐药性,包括氟喹诺酮类药物和链霉素[26,27,28]。这意味着选择这种补偿耐药菌株的抗生素浓度甚至可能低于我们在这里测量的浓度。
我们和其他人的发现的另一个重要含义是,广泛使用的突变选择性窗口的概念需要修改。因此,在药效学中,通常假设低于MIC的抗生素浓度不会产生选择,并且突变选择窗口(抗性突变体富集的浓度范围)在易感野生型的MIC和抗性突变体的MIC之间延伸[11,12]。然而,我们的结果表明,生物相关的亚MIC选择窗口要宽得多,需要包括比MICsusc低几百倍的抗生素浓度(图1A)。此外,本文描述的方法可用于探测不同环境中的生物活性抗生素浓度,例如动物模型。因此,通过在接受不同抗生素浓度处理的动物中进行基因标记的敏感菌株和耐药菌株之间的竞争,可以从耐药细菌的富集率推断细菌生长部位的抗生素生物活性浓度。
在高于菌株MIC的选择中,选择的主要驱动力是抗生素耐药性,而突变的适应成本则不那么关键。即使是成本非常高的突变也会被选中,因为易感细菌形式的竞争对手将被淘汰。然而,在亚MIC水平下,情况有所不同,因为易感细菌不会死亡,它们只会生长较慢。正因为如此,导致高适应成本的抗性突变不会被富集;只有适应成本低于抗生素对易感细菌的生长抑制的突变才会具有竞争力。这表明,在这种条件下,一个新的低成本或无成本耐药突变谱可能会丰富。图5中的数据表明,这些亚MIC水平的抗生素不仅能丰富已有的耐药突变体,还能从易感人群中重新选择耐药突变体。有趣的是,尽管使用了较低的抗生素浓度,但高耐药水平的突变体得到了富集。由于从头突变选择实验中选择的链霉素浓度与野生型和rpsL K42R突变之间竞争中确定的MSC浓度相同,因此富集的耐药细菌可能携带耐药突变,其适应成本显著低于之前研究的rpsL突变。
在本实验中,预先存在的突变体在与易感菌株的竞争中迅速富集。从数学模型中,我们可以推断出新发耐药突变体的类似情况,尤其是在uN.1和抗生素浓度为0.01,s,1.0的大群体中。在这些情况下,抗药性突变体会迅速出现,在100-1000代的生长期内,它们将接管种群。该模型得到了图5和图S2所示实验的支持,图5和图S2所示实验中,在存在亚MIC水平抗生素的情况下,在600-700代生长过程中,从头突变的频率不断增加。
总之,所提供的数据表明,在许多自然环境中存在的或在治疗期间在某些身体部位产生的非常低的抗生素水平与富集和维持预先存在的耐药突变体以及新突变体的从头选择有关。这些结果强调了引入降低环境中抗生素水平的措施的重要性,以及使用治疗剂量方案的重要性,该方案可防止抗生素亚MIC水平的延长时间。
材料和方法
菌株、遗传方法和生长条件
本研究中使用的菌株来源于大肠杆菌MG1655和鼠伤寒沙门氏菌血清型LT2(文中指定为鼠伤寒沙门氏菌),并在文中S1的表S1中列出。抗性菌株是通过P22转导(鼠伤寒沙门氏菌)或P1转导(大肠杆菌)将抗性基因导入亲本菌株而构建的。用于细菌生长的液体和固体培养基为穆勒-辛顿肉汤(美国马里兰州贝顿·迪金森)、穆勒-辛顿琼脂(穆勒-辛顿肉汤中添加1.5%琼脂)和卢里亚-贝尔塔尼(LB)琼脂(美国密苏里州西格玛·奥尔德里奇)。菌株在37℃下生长,液体培养物通过摇动通气。
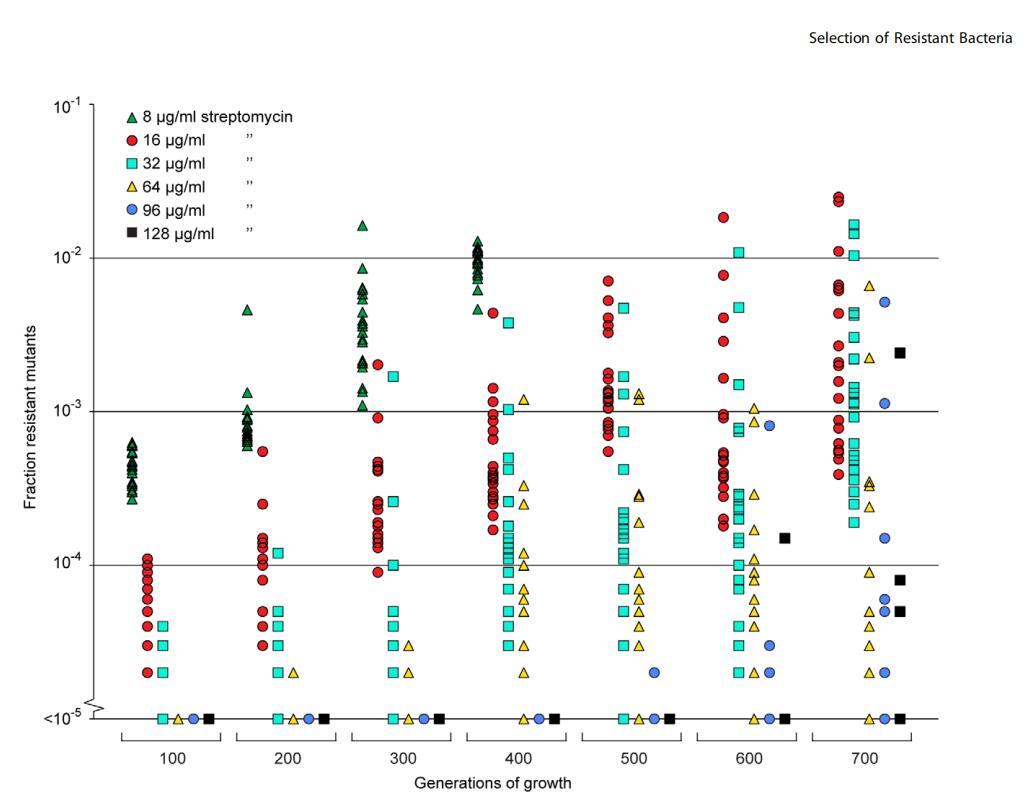
图5。选择抗生素亚抑制浓度下的新发耐药突变体。共有20个独立的鼠伤寒沙门氏菌谱系在含有1mg/ml链霉素的Mueller-Hinton培养基中连续传代。每100代约有105个细胞被接种到含有不同浓度链霉素的LB琼脂上,并计算耐药突变体的比例。数据点按生长世代数和耐药水平分组,在每个数据集中,一个数据点代表一个谱系中能够在指定抗生素浓度下生长的细胞比例。请注意,基线处的数据点将重叠。doi:10.1371/期刊。ppat。1002158.g005
增长率测量
使用Bioscreen C分析仪(Oy Growth Curves Ab Ltd,芬兰赫尔辛基)在37℃的Mueller Hinton肉汤中测量生长率,无论是否存在四环素。每口井接种1000倍稀释的过夜培养物,并在每种抗生素浓度下进行四次测量。培养物在连续摇动下生长24小时,每4分钟测量一次OD600。计算基于OD600值在0.02和0.1之间,其中生长呈指数增长。敏感菌株(DA6192)和耐药菌株(DA17822)在单独的实验中生长,相对生长率的计算方法为衍生生长率除以不使用抗生素生长的同一菌株的生长率。
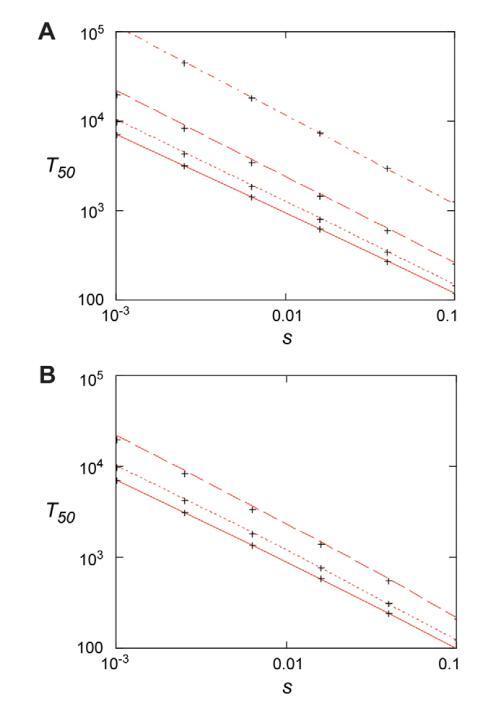
图6。适应性突变的固定时间。(A)当N=107且从上到下,u=1029、1028、1027和1026最初不存在突变体时,50%的穿透时间作为选择系数的函数。红线来自公式(4)和随机模型的交叉点,即公式(Eqs)。(7)–(10),m0=0。(B)。当突变体的初始存在由突变选择平衡决定时,50%的穿透时间作为选择系数的函数,m0=Nf0=uN/|s0|。结果是s0=20.02,N=107,从上到下,u=102610271028。红线来自公式(6),交叉点来自随机模型Eqs。(7)–(10).doi:10.1371/期刊。ppat。1002158.g006
麦克风测量
四环素和环丙沙星的MIC测定通过10毫升试管中的肉汤大稀释进行。在含有添加了不同浓度抗生素的米勒莱茵顿肉汤(1ml)的试管中接种1ml在37℃下生长的过夜细菌培养物。试管在37摄氏度下摇动培养16至18小时,四环素培养物避光以避免抗生素降解。MIC设置为抗生素的最低浓度,不会产生可见的生长。根据制造商(瑞典索尔纳AB bioMerieux)的说明,通过Etest测定链霉素的MIC。在37℃下培养16-18小时的穆勒-辛顿琼脂平板上进行ETEST试验。
竞争实验
竞争对手(103个细胞)的有限抽样通常会在竞争实验中引入统计上的不确定性,借助绿色荧光蛋白基因(gfp)的青色(cfp)或黄色(yfp)变体的染色体拷贝,可以获得更精确的抗药性突变体与野生型细胞比率的测量。它们允许使用荧光激活细胞分选机(FACS)跟踪大量单个细胞(105个细胞)。如前所述[29],使用l-Red系统将cfp/yfp基因插入galK,并通过噬菌体P22转导或噬菌体P1转导将其转移到各种菌株中。
在带有cfp或yfp的易感野生型菌株的Mueller-Hinton培养基中培养的隔夜培养物,混合比例为1:1、10:1、102:1,103:1和104:1,同基因抗性突变体携带另一个标记,每24小时通过1000倍连续稀释(导致每个连续传代10代生长)维持,最多4到6个连续传代。通过使用荧光激活细胞分类仪(BD FacsAria)计数105个细胞,在每个连续传代时确定群体中耐药细胞与敏感细胞的比率。选择系数是使用回归模型s=[ln(R(t)/R(0))]/[t]确定的,如前所述[30],其中R是抗性与易感的比率。该方案允许重复测定小到s=0.003[17]的适应度差异。每个野生型菌株的两个独立构建的集合(用cfp或yfp标记)也被包括在内,以测量与yfp相比,使用cfp标记对生长率的相对影响。这些对照实验表明,经过40代的竞争,标记之间的成本差异对生长率的影响可以忽略不计。(图S1)。由于新出现的四环素抗性突变体的出现需要很长时间,可能会干扰竞争实验,因此使用低初始比例的抗性突变体进行的竞争实验是用四环素完成的。
新进化抗性突变体的富集
为了研究亚抑制性抗生素浓度是否也能选择新产生的耐药突变株,敏感细菌在链霉素MIC的1/4和环丙沙星MIC的1/10处连续传代。在含有1mg/ml链霉素的Mueller-Hinton培养基中,共有20个鼠伤寒沙门氏菌LT2的独立谱系通过每24小时1000倍稀释在1ml分批培养基中连续传代700代(每连续传代10代),在含有2.3ng/ml环丙沙星的Mueller-Hinton培养基中,20个独立的大肠杆菌MG1655在1ml分批培养基中每24小时进行1000倍稀释,连续传代600代。这些谱系是从独立群体的隔夜培养开始的,最初的瓶颈是大约104个细胞,以尽量减少先前存在的抗性突变体的数量。通过每100代将大约105个细胞接种到含有不同浓度抗生素的LB琼脂上,并计数菌落数,监测每个培养基中耐药细胞的百分比。这些细胞的一个子集在相同的抗生素浓度下被重新破裂,以确认它们具有耐药性。
支持信息
图S1用yfp或cfp标记的两种野生型S型鼠伤寒菌株之间的竞争实验(菌株DA15110和DA15111,文本S1中的表S1)。每条线代表一个实验(四场比赛的平均值),共进行了四个独立实验。(TIF)
图S2抗生素亚抑制浓度下新发耐药突变体的选择。共有20个独立的大肠杆菌MG1655菌株在含有2.3 ng/ml环丙沙星的Mueller-Hinton培养基中连续传代。每100代约有105个细胞被接种到含有不同浓度环丙沙星的LB琼脂上,并计算耐药突变体的比例。数据点按生长世代数和耐药水平分组,在每个数据集中,一个数据点代表一个谱系中能够在指定抗生素浓度下生长的细胞比例。请注意,基线处的数据点将重叠。(TIF)
文本S1包含表S1(菌株的基因型和MIC)、表S2(指数增长率数据)、表S3(竞争数据)和附录(适应性突变的固定时间)。(博士)
作者构思并设计了实验:LS-DH-DIA。进行实验:例如CS OGB CI。分析数据:如LS OGB DH DIA。写这篇论文的人:例如。
