结果
pchA、pchC和pchF在菌株9866的2,4-二甲苯诱导细胞中高转录
pchC和pchF编码的PCMH和pchA编码的PHBDD被报道负责对甲苯酚的初始氧化,且PCMH对2,4-二甲苯有催化活性。因此,通过RT-qPCR进行pchA、pchC和pchF在不同诱导条件下的转录分析,以探究PCMH和PHBDD是否也参与2,4-二甲苯的初始氧化。结果表明,2,4-二甲苯诱导条件下pchA、pchC和pchF的相对转录水平分别比未诱导条件高6.5、8.3和4.5倍。类似地,对甲苯酚诱导条件下这三个基因的相对转录比未诱导条件分别高4.6、4.5和1.5倍(图2)。
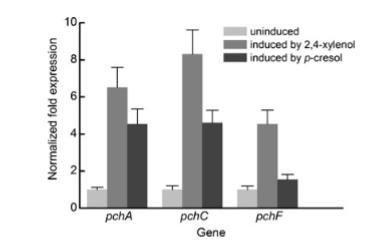
图2 通过RT-qPCR技术对9866菌株在诱导与非诱导条件下pchA、pchC和pchF基因的转录分析。所有样本均设置三个重复实验,误差线表示标准差
PCMH催化2,4-二甲苯氧化为4-羟基-3-甲基苯甲醛且其编码基因对2,4-二甲苯分解代谢是必需的
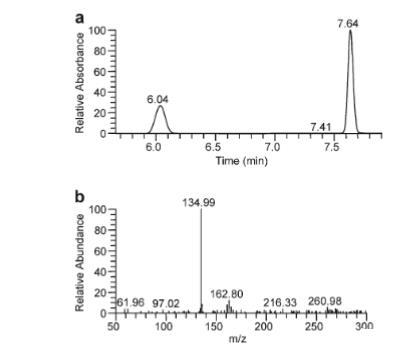
先前证明从菌株9866纯化的PCMH对2,4-二甲苯有催化活性,但产物未被鉴定。本研究中,从3,000 ml培养物中纯化得到总32 mg重组PCMH,比活性为0.18 U mg-1。化合物4-羟基-3-甲基苯甲醛被鉴定为产物,保留时间6.0分钟,最大吸收波长286 nm,质谱中稳定的去质子离子[M-H]- m/z=134.99(图3)。因此,PCMH被确认催化2,4-二甲苯氧化生成4-羟基-3-甲基苯甲醛。然而,推定的瞬时中间体4-羟基-3-甲基苄醇未被鉴定,因为其标准品商业不可用。
pchF编码PCMH的黄素蛋白亚基,且对其酶活性必需。为验证pchF和pchC编码的PCMH在2,4-二甲苯分解代谢中的作用,敲除pchF。结果显示,9866△pchF不再能以2,4-二甲苯或对甲苯酚作为唯一碳源和能源生长。然而,该突变体仍能在4-羟基-3-甲基苯甲醛或4-羟基苯甲醛上生长,这两个产物分别来自PCMH催化的2,4-二甲苯或对甲苯酚氧化。另一方面,pchF互补突变体9866△pchF[pRK415-pchF]恢复在2,4-二甲苯或对甲苯酚上生长的能力。这表明pchF和pchC编码的PCMH对菌株9866中2,4-二甲苯以及对甲苯酚的分解代谢是必需的。
PHBDD催化NADP+依赖的4-羟基-3-甲基苯甲醛氧化为4-羟基-3-甲基苯甲酸
表2 pchA编码的PHBDD对4-羟基苯甲醛和4-羟基-3-甲基苯甲醛的动力学参数
| 底物 | 辅因子 | Km (μM) | Kcat (min⁻¹) | Kcat/Km (μM⁻¹ min⁻¹) |
|---|---|---|---|---|
| 4-羟基苯甲醛 | NADP+ | 3.57 ± 0.32 | 15.82 ± 0.36 | 4.4313 ± 0.2992 |
| 4-羟基苯甲醛 | NAD+ | 13.11 ± 1.78 | 0.10 ± 0.00 | 0.0076 ± 0.1111 |
| 4-羟基-3-甲基苯甲醛 | NADP+ | 6.36 ± 1.44 | 4.27 ± 0.27 | 0.6714 ± 0.1165 |
| 4-羟基-3-甲基苯甲醛 | NAD+ | 20.55 ± 1.91 | 0.10 ± 0.00 | 0.0049 ± 0.0005 |
据报道,PHBDD在对甲苯酚分解代谢中催化NADP+依赖的4-羟基苯甲醛氧化为4-羟基苯甲酸。本研究中,从200 ml培养物中纯化得到总26 mg重组PHBDD,比活性为7.55 U mg-1。发现PHBDD能催化2,4-二甲苯分解代谢中4-羟基-3-甲基苯甲醛脱氢生成4-羟基-3-甲基苯甲酸,以NADP+或NAD+作为辅因子。动力学测定显示,PHBDD对4-羟基-3-甲基苯甲醛的Km值以NADP+(6.36±1.44μM)低于以NAD+(20.55±1.91μM)(表2)。就Kcat/Km效率而言,PHBDD对4-羟基-3-甲基苯甲醛以NADP+的效率比以NAD+高约三个数量级。因此,除了催化对甲苯酚分解代谢中4-羟基苯甲醛氧化外,PHBDD也催化2,4-二甲苯分解代谢中NADP+依赖的4-羟基-3-甲基苯甲醛氧化为4-羟基-3-甲基苯甲酸。另一方面,PHBDD对4-羟基苯甲醛(在对甲苯酚分解代谢中)的Km值(3.57±0.32μM)明显低于对4-羟基-3-甲基苯甲醛(6.36±1.44μM)(在2,4-二甲苯分解代谢中),且其对4-羟基苯甲醛的催化效率比对4-羟基-3-甲基苯甲醛高六倍。
其他PHBDD可能参与2,4-二甲苯和对甲苯酚分解代谢
为检验pchA编码的PHBDD在2,4-二甲苯分解代谢中的作用,敲除并互补pchA。出乎意料地,菌株9866△pchA仍能在2,4-二甲苯和对甲苯酚以及其氧化产物相应苯甲醛和苯甲酸上生长。此外,在菌株9866△pchA对2,4-二甲苯和对甲苯酚的生物转化过程中,同时检测到4-羟基-3-甲基苯甲酸和4-羟基苯甲酸。这暗示除pchA编码的PHBDD外,存在其他具有PHBDD活性的酶。
| 生长碳源 | 菌株 | 调整后 R² | μm (h⁻¹) |
|---|---|---|---|
| 2,4-二甲苯 | 9866 | 0.9731 | 0.16 |
| 2,4-二甲苯 | 9866△pchA | 0.9650 | 0.06 |
| 4-羟基-3-甲基苯甲醛 | 9866 | 0.9014 | 0.06 |
| 4-羟基-3-甲基苯甲醛 | 9866△pchA | 0.9713 | 0.04 |
| 对甲苯酚 | 9866 | 0.9673 | 0.16 |
| 对甲苯酚 | 9866△pchA | 0.9647 | 0.09 |
| 4-羟基苯甲醛 | 9866 | 0.9557 | 0.32 |
| 4-羟基苯甲醛 | 9866△pchA | 0.9893 | 0.11 |
细菌生长实验也支持上述推论。菌株9866对所有测试底物的最大比生长速率(μm,每小时)高于菌株9866△pchA,如表3所示。这表明pchA缺失导致2,4-二甲苯、对甲苯酚、4-羟基-3-甲基苯甲醛和4-羟基苯甲醛的分解代谢速率下降。此外,菌株9866对4-羟基-3-甲基苯甲醛(6.05±0.05 U mg-1)和4-羟基苯甲醛(4.50±0.39 U mg-1)的比活性分别比菌株9866△pchA高60%。这些结果表明,尽管可能存在PHBDD同源物,pchA编码的PHBDD在2,4-二甲苯和对甲苯酚分解代谢中起主要作用。
讨论
先前,pchC和pchF编码的PCMH和pchA编码的PHBDD被报道负责对甲苯酚利用菌株9866中对甲基的氧化。本研究中,2,4-二甲苯诱导细胞中pchC、pchF和pchF的高转录表明PCMH和PHBDD可能也参与2,4-二甲苯的分解代谢。pchC和pchF被证明位于两个不同操纵子上,且pchA和pchC在本研究中通过反转录PCR发现在同一操纵子上。pchAC和pchF之间的相对转录水平差异显然是因为它们位于不同操纵子且独立转录。酶活性测定和中间体鉴定显示,PCMH和PHBDD分别催化2,4-二甲苯氧化为4-羟基-3-甲基苯甲醛和4-羟基-3-甲基苯甲醛氧化为4-羟基-3-甲基苯甲酸。然而,先前报道中PCMH对对甲苯酚的Km值低于对2,4-二甲苯,且本研究中发现PHBDD对4-羟基苯甲醛的Km值也低于对4-羟基-3-甲基苯甲醛。这表明对甲苯酚和4-羟基苯甲醛在对甲苯酚分解代谢中可能分别是菌株9866中PCMH和PHBDD的生理底物。
另一方面,发现PCMH编码基因对2,4-二甲苯和对甲苯酚分解代谢是必需的,而PHBDD编码基因对分解代谢非必需。除pchA编码的PHBDD外,对9866△pchA对不同中间体的最大比生长速率和比活性分析揭示可能存在其他具有PHBDD活性的酶。确实,几个苯甲醛脱氢酶类似物被报道在 several 菌株中展示对4-羟基苯甲醛的活性,如恶臭假单胞菌质粒pWW0上的xylC编码的苯甲醛脱氢酶、乙酸钙不动杆菌的苯甲醛脱氢酶II和不动杆菌属菌株ADP1的areC编码的苯甲醛脱氢酶,尽管这些酶未测试对4-羟基-3-甲基苯甲醛。
此外,PCMH和PHBDD编码基因(pchC、pchF和pchA)本研究中也被显示参与2,4-二甲苯的初始分解代谢,且位于菌株9866的质粒pRA4000上,纠正了先前2,4-二甲苯利用结构基因位于染色体上的结果。除PCMH和PHBDD外,也通过基因组步移和酶活性测定努力寻找负责2,4-二甲苯下游分解代谢途径的其他基因和酶。然而,在质粒pRA4000中未发现负责2,4-二甲苯邻甲基氧化和4-羟基异酞酸羟化酶的编码基因。菌株9866中2,4-二甲苯利用结构基因可能分布在质粒和染色体上。
有趣的是,编码推定转座酶和解离酶的基因(tnpA和tnpR)被发现侧翼PCMH和PHBDD编码基因(pchC、pchF和pchA)及pRA4000中为原儿茶酸邻位开环途径识别的推定结构基因(图1b)。这暗示转座可能在2,4-二甲苯和对甲苯酚分解代谢途径的进化中发生。此外,催化2,4-二甲苯邻甲基初始羟化的4-羟基-3-甲基苯甲酸羟化酶被认为是单加氧酶,与负责对甲基初始羟化的PCMH脱氢酶对比。有人提出vanillate脱甲基酶可能被招募并进化为4-羟基-3-甲基苯甲酸羟化酶作为2,4-二甲苯途径的一部分。这些推测与本研究结果一起表明,参与2,4-二甲苯分解代谢的酶基因可能从多种起源进化而来。
相关新闻推荐
1、活菌计数:MTT比色法、 ATP生物发光法和高通量生长曲线法哪个更准
2、高效降解豆粕碳水化合物和蛋白的菌株筛选及发酵条件优化(一)
