3.2.转录分析的一般特征
为了评估从感染φR1-37噬菌体的YeO3-R1细菌中分离的总RNA的质量和完整性,进行了Bioanalyzer(Agilent)检测。结果表明RNA质量足以进行文库制备和RNA测序(图S1)。对样品质量进行了目视检查,由于推测小肠结肠炎耶尔森菌O:3中23S rRNA被切割[24],无法计算RNA完整性数(RIN)。然而,Bioanalyzer电泳凝胶显示,在感染过程中,RNA样品的降解显著增加并呈进行性(图S2)。结肠噬菌体T4不仅通过影响宿主基因的转录,还通过改变现有mRNA的稳定性来终止宿主基因的表达[25]。虽然尚不清楚观察到的降解是由什么引起的,或者是否超出了rRNA,但有可能这是φR1-37使用类似机制接管宿主细胞代谢的结果,从而导致不同宿主RNA物种稳定性的改变,进而导致其部分降解。
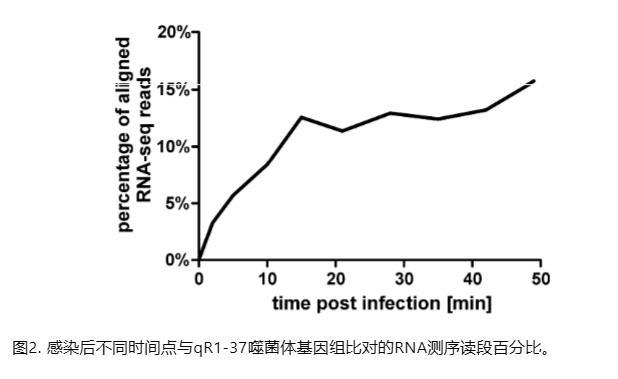
为了分析转录组的变化,将RNA测序读数以链特异性方式比对到宿主和噬菌体基因组。我们的结果表明,宿主读数逐渐被噬菌体读数替换,从2分钟样本的3.27%开始,在最后一个时间点达到峰值15.71%(图2;表S1)。这代表噬菌体转录本的相对积累显著低于φKZ感染中发现的45%[3]。
评估每个样本之间协方差的主成分分析(PCA)显示,后续时间点的样本之间逐渐分化,并且非感染阴性对照与最初几个时间点之间存在明显差异(图S3)。基于这些结果,可以将单个时间点样本分为四组以进行相关的统计分析:早期阶段(2和5分钟)、中期阶段(10、15和21分钟)、晚期阶段(28、35、42和49分钟)以及感染前立即采集的非感染阴性对照(0分钟)。重要的是,这些组代表从同一感染瓶中采集的技术重复。
3.3.φR1-37转录的时间调控
通过将每个测量时间点比对到噬菌体基因组任一条链的读数每250 bp汇总成一个计数表,通过Total Count(TC)将每个样本中比对到噬菌体的读数彼此标准化,并分别绘制每条链,可以可视化感染过程中每个测量点的噬菌体转录(图3A)。该图谱显示在整个早期、中期和晚期阶段,基因转录模式基本稳定。分析的大多数基因在所有研究的时间点都呈现出相当相似的表达模式。只有选定的基因在比较感染早期和晚期时显示出表达上的明显差异(表S2)。对早期(2-5分钟)、中期(10-21分钟)和晚期(28-49分钟)阶段单个基因平均读数的比较表明了四种不同的基因表达模式的存在(图3B)。第一组包含92个φR1-37基因,其转录本在感染的前10分钟内积累,因此可归类为早期基因。
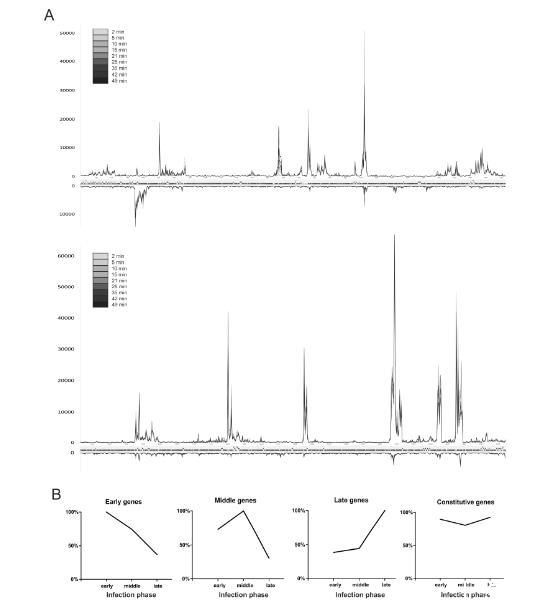
图3. pR1-37噬菌体基因组在感染周期中的转录进程。每个时间点均绘制了与噬菌体基因组双链每250 bp片段比对成功的读数数量(A)。曲线颜色从灰到黑的深浅变化表示连续的时间点(面板A的高分辨率图像参见图S4)。qR1-37基因表达的不同时间类别(B)。每个基因在感染阶段的最高总基因读数(TGR)值被设定为100%,其余数值相应调整。基因被分为四个时间类别,曲线代表各类别的平均值。
第二组(8个基因)的转录本丰度在感染后15至28分钟达到最大水平,可归类为中期基因。第三组94个基因的转录本数量随时间增加,在35至49分钟之间达到峰值,归类为晚期基因。最后,最大的第四组包含147个φR1-37基因,它们在感染后不同时间点的丰度没有显著变化,被归类为组成型表达基因。在367个基因中,有26个因其在这些采样条件下表达水平极低而被排除。未观察到基因的基因组位置与表达模式之间存在明确的关联。这些发现完全偏离了典型的时间模式,即转录本从早期基因转向晚期基因,并且同一类基因在基因组中成簇分布,正如在其他几种使用RNA-seq[3,4]或旧方法[26-29]的噬菌体中所观察到的那样。由于大多数φR1-37基因缺乏明确的功能注释,目前甚至无法推测许多组成型表达基因的功能。
在92个早期基因中,有87个与已知基因没有相似性(表S2)。其他早期基因编码一种内型膜结合裂解性胞壁质转糖基酶(g331)、一个含有Pro-Ala-Ala-Arg(PAAR)重复序列的蛋白质(g142)以及,出乎意料地,两个病毒体结构蛋白(g088,g094)。18个中期基因中只有一个具有预测功能,即一个推定的RNA结合蛋白(g284)。大多数参与DNA复制和修复的基因(30个中的22个)被归类为晚期基因。晚期基因(n=94)包含,其中包括20个编码病毒体结构蛋白的基因、四个核苷酸代谢基因和三个RNAP及RNA相互作用基因。有趣的是,大多数编码病毒体结构蛋白的基因(70个中的48个)被归类为组成型,在整个感染过程中显示稳定的表达。类似地,七个编码DNA复制和修复因子的基因、两个编码ATP酶的基因以及三个编码参与核苷酸代谢的因子的基因被归类为组成型(表S2)。此外,两个注释为编码裂解相关蛋白的基因(g084和g289)也属于同一类别,尽管它们的表达水平与具有最高TGR值的基因之一——编码裂解蛋白的g331相比非常低(表S2)。需要进一步的研究来通过实验确定g084和g289产物的功能以及它们组成型表达对宿主裂解的可能影响。虽然我们观察到两个预测参与裂解的基因与标准感染模型[30]相反,但这可能表明存在像噬菌体T4中发现的复杂裂解抑制机制[31]。
另一方面,在具有最高TGR值的基因中,我们鉴定出编码病毒体结构蛋白(g326,g176,g083,g174,g099)、ATP酶(g304,g061)和裂解蛋白(g331)的基因。没有读数比对到基因g067,g106,g109,g116,g165,g166,g172,g180,g181,g188,g200,g201,g217,g232,g288,g312,g315,g316和g357。关于噬菌体基因表达的详细信息见表S2。
RNA测序数据支持我们之前的Northern印迹结果,提供了φR1-37转录的总体概览[21]。与Northern印迹一致,我们在此显示基因g072-g072,g103,g170和g329晚期表达,并且g231基因表达是组成型的。基因g048-g049,g145,g281和g298的不一致结果可以通过它们的转录本TGR值非常低来解释。这些转录本的低丰度以及早期时间点噬菌体转录本普遍较低丰度,使得Northern印迹分析具有挑战性。在这种情况下,高灵敏度的RNA测序被证明是更可靠的方法。
早期研究表明,编码与细菌RNAPβ和β'亚基相似的蛋白质的基因在所有已知的φKZ相关噬菌体中都是保守的[32]。在φKZ中,四个编码组成型病毒RNAP的基因是中期和/或晚期基因,而编码非病毒体RNAP的基因在早期阶段表达[3]。在体外,φKZ的RNAP复合物以利福平抗性的方式从晚期噬菌体启动子启动转录。此外,φKZ RNAP不具有细菌、古菌或真核生物聚合酶特征性的组装和启动子特异性亚基[32]。我们的研究表明,在φR1-37中,编码RNAP亚基的g274、g102和g261基因是晚期且高表达的。其余三个(g178,g231和g099)从感染的最早阶段开始组成型表达,并且具有中等到高的转录本丰度。先前假设φR1-37在感染早期将β和β'亚基引入宿主细胞以接管转录[21,33]。有可能,与φKZ类似,φR1-37噬菌体强烈依赖其自身的RNAP并在整个感染过程中使用它。
相关新闻推荐
1、砷氧化菌株在砷胁迫中生长曲线测定及重金属铜的耐受性(二)
