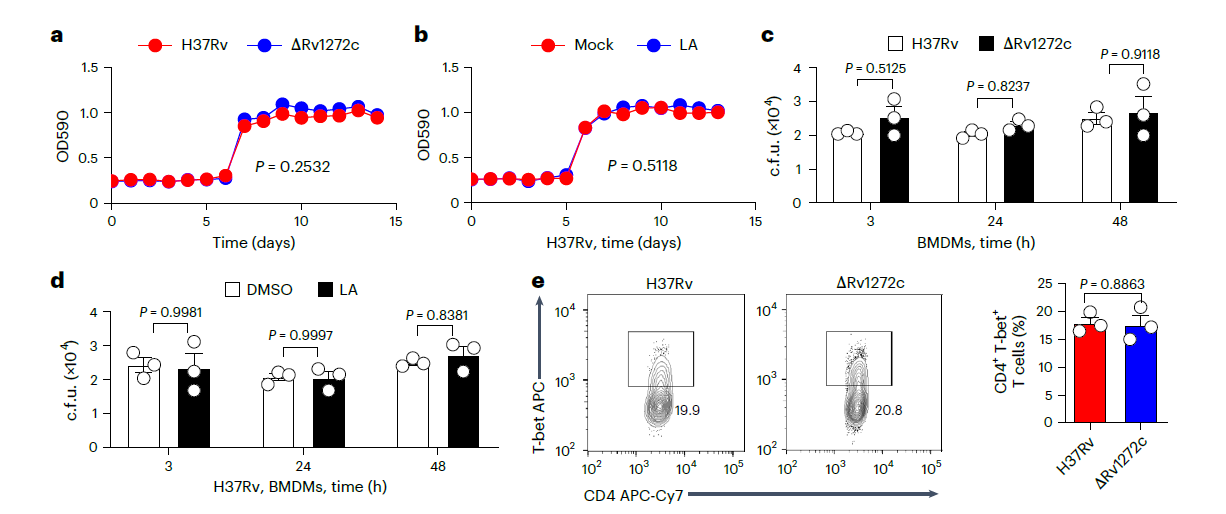
图2、Rv1272c和亚油酸通过Treg细胞促进分枝杆菌存活。a,b)指示的Mtb菌株(a)或H37Rv±亚油酸(b)在14天(37°C)内的体外生长曲线。c,感染H37Rv或ΔRv1272c菌株的BMDM中的细胞内c.f.u.。d,用H37Rv感染BMDM并用亚油酸或DMSO处理。细胞内c.f.u.在指定时间内测定。例如,C57BL/6小鼠被指定的Mtb菌株(~200 c.f.u.)气溶胶感染4周。使用流式细胞术(FCM)测量CD4+T-bet+(e)、CD8+T-bet+
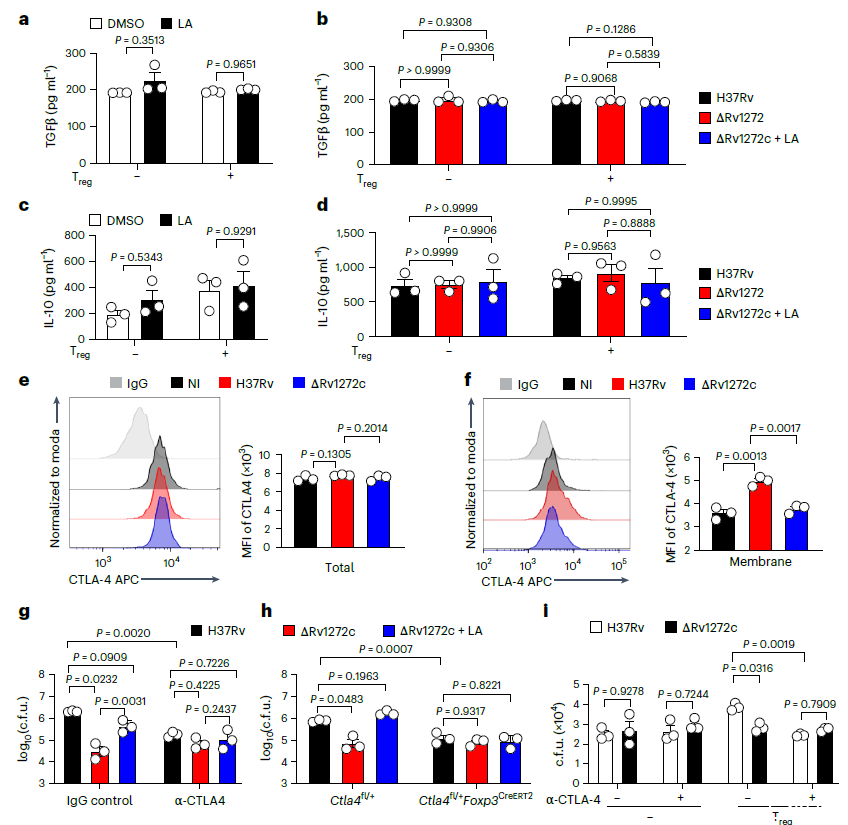
图3、Rv1272c和亚油酸增强了Treg细胞上的CTLA-4表面运输。a-d,在感染H37Rv(a,c)或指示的Mtb菌株(b,d)1 d后,将BMDM与或不与亚油酸处理的CD4+T reg细胞共孵育1天;ELISA法检测培养上清液中TGFβ(a,b)和IL-10(c,d)水平。e,f,在感染指定Mtb菌株1 d后,将BMDMs与CD4+Treg细胞共孵育1 d,用FCM测量CD4+T reg细胞中总CTLA-4水平(e)和膜CTLA-4水平(f)的MFI。g,在感染后4、8、12、16、20和24天用同种型对照IgG或抗CTLA-4抗体(每只小鼠500μg)处理的C57BL/6小鼠被气溶胶感染,每只小鼠约200 c.f.u.指示的Mtb菌株;然后,通过饮用水对受感染的小鼠进行亚油酸或不亚油酸治疗。h)在感染后,8,12,16,20和24天用他莫昔芬治疗的Ctla4fl/+或Ctla4fl/+Foxp3CreERT2小鼠被气溶胶感染,每只指定Mtb菌株的小鼠约200c.f.u.,持续4周。使用c.f.u.测定法测量小鼠肺部的细菌负荷。i)在感染指定Mtb菌株1天后,将BMDM与或不与用同种型对照IgG或抗CLTA-4抗体(40μg ml−1)处理的CD4+T reg细胞共孵育1天。
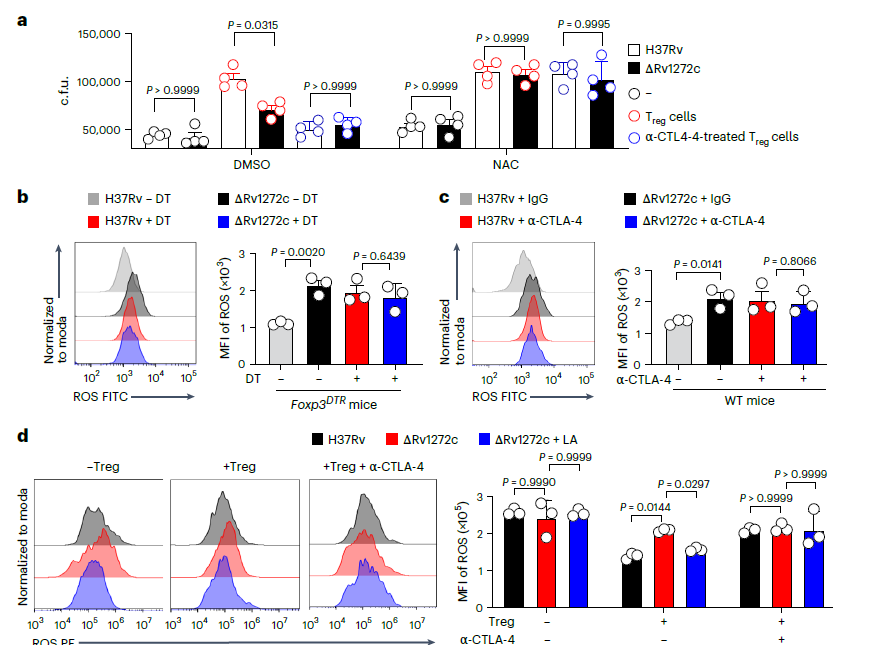
图4、Rv1272c通过CTLA-4介导的ROS抑制来损害巨噬细胞的抗分枝杆菌能力。a)用DMSO或NAC(ROS抑制剂)预处理24 h,然后与同种型对照IgG或抗CTLA-4阻断抗体(40μg ml−1)处理的Treg细胞共培养1 d;使用c.f.u.测定法测定指定Mtb菌株在感染2天的BMDM中的细胞内存活率。b)在感染后4、8、12、16、20和24天用DT或PBS处理的C57BL/6或Foxp3DTR小鼠被气溶胶感染,每只小鼠约200 c.f.u.指示的Mtb菌株,持续4周。采用FCM法测定肺组织分选的F4/80+巨噬细胞中ROS水平的MFI。c)用同种型对照IgG或抗CTLA-4抗体(每只小鼠500μg)处理的C57BL/6小鼠被气溶胶感染,每只小鼠约200 c.f.u.指示的Mtb菌株,持续4周。采用FCM法测定肺组织分选的F4/80+巨噬细胞中ROS水平的MFI。d、在指定Mtb菌株感染1 d后,将BMDM与或不使用亚油酸处理的CD4+Treg细胞共孵育,或用同种型对照IgG或抗CLTA-4抗体(40μg ml−1)共孵育1 d;采用FCM检测BMDMs中ROS水平的MFI。
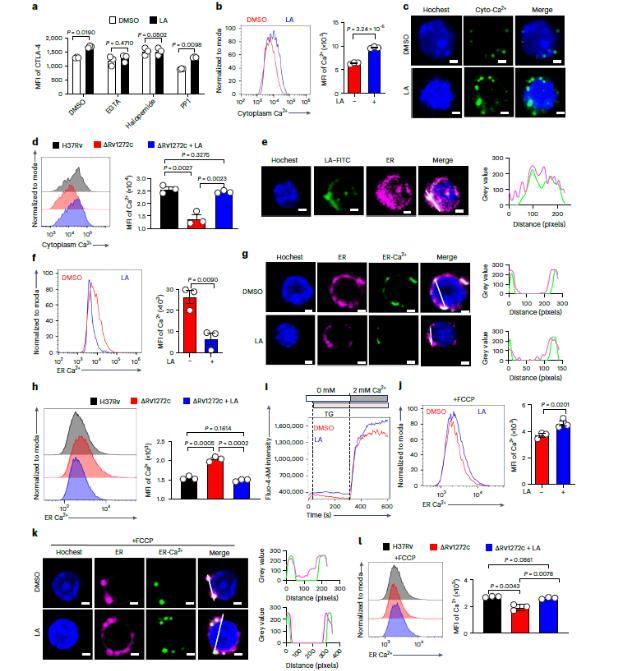
图5、亚油酸促进Ca2+依赖性CTLA-4表面运输。a,e)在IL-2和TGFβ存在下用抗CD3和抗CD28抗体刺激幼稚CD4+T细胞3天,并用DMSO或亚油酸(a)和FITC-亚油酸(e)处理。a)使用指示的抑制剂处理CD4+Treg细胞24 h。采用FCM法测定膜CTLA-4水平的MFI。e)分析了FITC-亚油酸与内质网的共定位(比例尺,1μm)。右,白线的像素强度图。b,c)CD4+Treg细胞用DMSO或亚油酸处理24 h。使用FCM(b)和免疫荧光分析(c;比例尺,1μm)评估游离细胞质Ca2+。d)在指定Mtb菌株感染1 d后,将BMDMs与亚油酸处理的CD4+Treg细胞共孵育±1 d;使用FCM评估Treg细胞中的游离细胞质钙。f,g)CD4+Treg细胞用DMSO或亚油酸处理24 h。使用FCM(f)和免疫荧光分析(g;比例尺,1μm)评估游离内质网钙。h)在指定Mtb菌株感染1 d后,将BMDMs与亚油酸处理的CD4+Treg细胞共孵育±1 d;通过FCM评估Treg细胞中的游离ER钙浓度。i)用FCM检测thapsigargin(TG)诱导的SOCE在用或不用亚油酸处理的CD4+Treg细胞中。j,k)CD4+Treg细胞用DMSO或亚油酸处理24小时。在FCCP处理(j)和免疫荧光分析(k;比例尺,1μm)下使用FCM评估Treg细胞中的游离ER钙。右,白线的像素强度图。l)在指定Mtb菌株感染1 d后,将BMDMs与亚油酸或不亚油酸处理的CD4+Treg细胞共孵育1 d。
总结
调节性T(T reg)细胞在结核分枝杆菌(Mtb)感染期间扩增并抑制T细胞介导的对照。在这里使用全基因组突变体文库,表明Mtb Rv1272c(一种ATP结合盒转运蛋白)的表达在缺氧条件下增加,并通过增加卵磷脂输入促进Mtb在体内存活,然后产生和释放亚油酸。受感染巨噬细胞释放的亚油酸通过Ca²⁺转运蛋白ATP2a3促进免疫检查点分子细胞毒性T淋巴细胞抗原4(CTLA-4)的表面运输。这反过来又抑制了巨噬细胞活性氧的产生并促进了巨噬细胞内的Mtb存活。
Rv1272c诱导的亚油酸通过增加体内Treg细胞上的CTLA-4表面运输,进一步促进Mtb免疫逃逸。从机制上讲,亚油酸与Treg细胞中的ATP2a3相互作用并促进线粒体相关的内质网(ER)膜形成。这促进了内质网到线粒体的Ca2+转移和内质网中Ca2+的消耗,并触发储存作的钙进入,从而提高胞质Ca2+水平,以增加Treg细胞中Ca2+依赖性CTLA-4表面运输。
这些发现表明,Mtb可以使用代谢物来纵宿主反应并促进其细胞内存活。Bioscreen C全自动微生物生长曲线分析仪在本研究中扮演了“基础表型验证者”的角色。通过提供精确、自动化的体外生长动力学数据,它有效地排除了Rv1272c基因影响细菌基本生长的可能性,从而将后续的研究焦点成功地引导至其真正的功能——即在宿主感染环境中通过代谢产物亚油酸来调控免疫反应。Bioscreen C允许同时监测多个菌株的复孔,提高了实验效率并确保了条件的一致性。
长达14天的自动监测有效捕捉了生长缓慢的分枝杆菌的完整生长周期(迟缓期、对数期、稳定期),避免了手动测量可能带来的时间点遗漏或污染风险。本研究揭示了一条由病原体代谢物驱动的免疫逃避新通路,表明靶向Treg细胞或CTLA-4可能作为结核病的潜在免疫治疗策略。然而其与一线结核药物的协同效果及安全性仍需在动物模型和临床试验中进一步评估。综上所述,本研究得出结论,Mtb通过Rv1272c-亚油酸-ATP2a3-Ca²⁺-CTLA-4信号轴,主动上调Treg细胞的抑制功能,进而抑制巨噬细胞的抗菌活性,最终促进其胞内寄生生存。这为理解结核病的免疫病理机制和开发新的治疗干预手段提供了重要见解。
相关新闻推荐
1、酱香型白酒堆积酒醅中分离克罗彭斯特德菌生长和挥发性化合物代谢特征(二)
2、不同pH和菌体比生长速率对S.albulusM-Z18合成ε-PL的影响
