在基因与疾病的研究领域,DNA序列的突变一直是核心焦点。但南方科技大学刘星吟团队的研究揭示了一个更复杂的调控网络——MDME轴(Microbiota-Derived Metabolite-Epigenetic axis)。这一框架证明,肠道菌群通过代谢产物对宿主基因表达的表观遗传重塑,正在颠覆传统对"基因决定论"的认知。
代谢物的三级分类体系
微生物代谢产物(MDMs)的来源可被系统划分为三个层级。第一类是膳食成分转化产物,包括短链脂肪酸(SCFAs)、色氨酸代谢物、支链氨基酸和多酚衍生物。第二类源自宿主合成物的微生物改造,如胆汁酸及其衍生物。第三类则是微生物自主合成的化合物,涵盖部分支链氨基酸和维生素。这种分类不仅体现代谢路径的差异,更暗示着调控机制的多样性。
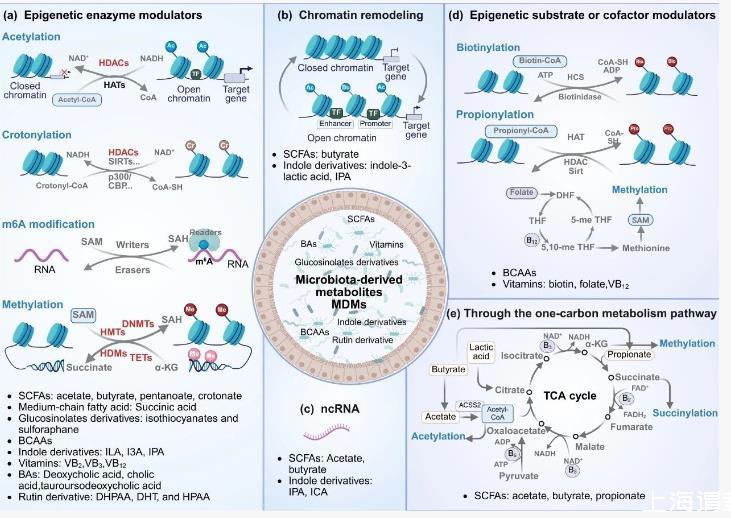
四通道耦合的调控网络
MDME轴通过四条平行路径实现表观遗传重塑:① 直接调节组蛋白修饰酶活性;② 改变底物或辅因子可用性;③ 重塑染色质高级结构;④ 干预非编码RNA表达。以SCFAs为例,丁酸盐既可作为HDAC抑制剂维持组蛋白乙酰化,又能通过影响SAM合成间接调控DNA甲基化。这种多通道耦合特性使单一代谢物可能产生多重表观遗传效应。
空间特异性的全身调控
研究显示MDME轴具有显著的空间分布特征。肠道局部的代谢物浓度可达血液中的百倍以上,而胆汁酸衍生物则通过肝肠循环形成闭环调控。更值得注意的是,部分代谢物如色氨酸代谢产物可穿透血脑屏障,在中枢神经系统建立表观遗传信号传递通路。这种跨器官的调控网络解释了为什么肠道菌群失调会引发远端器官疾病。
疾病谱系的表观遗传印迹
在疾病层面,MDME轴的作用已得到多项验证。结直肠癌患者的肠道菌群代谢谱显示,特定SCFA水平与DNA甲基化异常存在显著相关性。代谢综合征中观察到的组蛋白乙酰化改变,与肠道菌群产生的短链脂肪酸浓度下降呈负相关。神经退行性疾病研究发现,色氨酸代谢物介导的组蛋白去乙酰化酶抑制,可能影响神经营养因子的表达。
技术瓶颈与突破方向
当前研究面临多重技术挑战。因果链条的验证依赖于严格的动物模型与临床队列结合,但现有研究多停留在相关性分析层面。组织特异性解析需要整合单细胞表观组学与空间转录组学技术。新型表观修饰如组蛋白巴豆酰化的作用机制,仍需开发特异性检测工具。转化应用层面,代谢物递送系统的靶向性设计和长期安全性评估是关键障碍。
双向调控的动态平衡
MDME轴并非单向作用,而是构建了宿主与微生物的双向调控回路。宿主的表观遗传状态通过改变肠道免疫微环境,反过来塑造微生物群落结构。这种动态平衡解释了为什么饮食干预可能产生持续性的菌群重构效应。例如,高纤维饮食通过SCFA生成促进组蛋白乙酰化,进而上调抗菌肽表达,最终改变肠道菌群组成。
未来研究的技术路线
解决当前研究瓶颈需要多技术协同突破。空间转录组学可揭示代谢物在器官内的分布梯度,单细胞表观组学能解析细胞类型特异性响应。开发代谢物-酶互作的CRISPR筛选系统,有助于鉴定关键调控节点。针对新型表观修饰的化学探针开发,将推动表观遗传图谱的全面重构。在转化层面,纳米载体介导的代谢物靶向递送系统,可能突破血脑屏障等生理屏障限制。
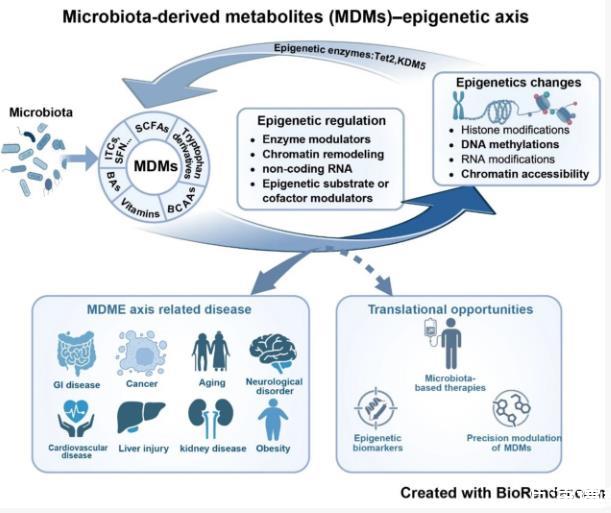
研究范式的范式转移
MDME轴的提出标志着表观遗传学研究的范式转移。传统研究聚焦于宿主基因组与环境因素的相互作用,而该框架引入微生物代谢物作为独立变量,构建了包含宿主、微生物、代谢物三元组的新型研究体系。这种范式转变不仅拓展了表观遗传学的研究边界,更为多系统疾病的机制解析提供了全新视角。在衰老研究领域,肠道菌群代谢物介导的表观遗传重编程,可能成为延缓组织功能退化的潜在靶点。
该研究框架的价值在于其揭示了微观与宏观尺度的统一性。从单个代谢物分子到多器官系统,从短期生理调节到长期疾病发展,MDME轴展现了生命系统的复杂调控网络。这种多尺度、多维度的视角,正在重塑我们对健康与疾病本质的理解,也为精准医学的发展开辟了新路径。
相关新闻推荐
1、不同浓度冠菌素对番茄防御基因表达、胼胝质沉积及野生型致病菌生长的影响(四)
2、基因组中的环境“指纹”:GenomeSPOT解锁85,000种微生物生长秘密的新钥匙
