使用质粒pJL84构建针对fruA(PfruA-cat)、levD(PlevD-cat)和manL(PmanL-cat)启动子的CAT报告基因融合,方法是将包含启动子的DNA片段(包括同源核糖体结合位点)插入到缺乏核糖体结合位点的金黄色葡萄球菌无启动子cat基因前面。通过SphI和SacI限制性酶切释放启动子-cat融合片段,并亚克隆到整合载体pMJB8中,该载体允许将DNA插入片段以单拷贝形式递送到戈登氏链球菌染色体上的gtfG基因中。所有基因融合在转化戈登氏链球菌前均通过DNA测序确认,并通过PCR确认所得分离株中整合盒的正确构型。
生化测定。细菌培养物在补充了各种碳水化合物的30 ml TV基础培养基中培养至指数中期,通过离心收集细胞,用相同体积的10 mM Tris缓冲液(pH 7.8)洗涤一次,重悬于750μl相同缓冲液中,然后在Bead Beater(Biospec Products,Bartlesville,OK)中均质化30秒,两次,间隔冰上2分钟。在4°C下以18,000 x g离心10分钟后,回收上清液用于通过Shaw的方法测量CAT活性。裂解液的蛋白质浓度通过Bradford(Bio-Rad)或二辛可宁酸(BCA;Thermo Scientific)测定法确定。CAT活性表示为每分钟每毫克蛋白质乙酰化的氯霉素纳摩尔数。
PEP依赖性PTS测定根据别处描述的方案进行,略有修改。简言之,在含有0.5%指定碳水化合物的TV基础培养基中厌氧生长的30 ml培养物在指数晚期(600 nm光密度[OD600]=0.5至0.6)收获,用30 ml含有5 mM MgCl2的100 mM Na-K-PO4缓冲液(pH 7.2)洗涤两次,重悬于1 ml相同缓冲液中,然后通过涡旋振荡与50μl甲苯-丙酮(1:9,体积比)处理2分钟(两次,间隔冰上2分钟)进行透化处理。在这些测定中使用厌氧生长的细胞,因为存在氧的情况下生长的细胞具有高水平的NADH自发氧化,干扰测定,这显然与NADH氧化酶的诱导有关。然后对透化细胞进行PTS测定。使用BCA测定法测量样品的蛋白质浓度,PTS活性以PEP依赖性方式表示为每分钟每毫克蛋白质氧化的NADH纳摩尔数。
结果
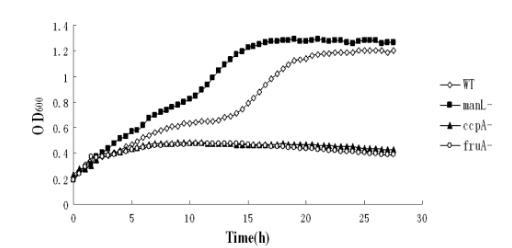
戈登氏链球菌中fruA、levD和manL同源物的鉴定。为了在戈登氏链球菌DL1株的基因组中找到同源的外切-β-D-果糖苷酶(fruA)基因,使用变形链球菌的fruA蛋白序列(SMU.78;GenBank基因座标签)在http://www.oralgen.lanl.gov对戈登氏链球菌Challis基因组序列进行BLAST搜索。鉴定出一个同源的开放阅读框(ORF)SGO_0385(Oralgen基因ID),也注释为外切-β-D-果糖苷酶。预测戈登氏链球菌的fruA基因编码一个1408个氨基酸残基的多肽,与血链球菌、变形链球菌和唾液链球菌的β-果糖苷酶分别具有95%、58%和56%的同一性。BLAST搜索中鉴定出的第二个最相近的基因产物是蔗糖-6-磷酸水解酶(SGO_1302)。为了验证fruA作为果糖苷酶的功能,通过等位基因交换用非极性红霉素抗性决定簇(em)构建了fruA突变体,并在含有0.05%葡萄糖和0.5%β2,1-连接的果糖同聚物菊粉的TV培养基中测试其生长。虽然野生型菌株正常生长,呈现典型的二次生长曲线,但fruA突变体在葡萄糖耗尽后停止生长(图1)。因此,该现象表明戈登氏链球菌的fruA基因编码功能性果聚糖水解酶。额外的测试证实fruA突变体在利用葡萄糖方面没有缺陷,并且如果菊粉是培养基中唯一的碳水化合物来源则完全不能生长(数据未显示)。
类似地,使用变形链球菌的果糖/甘露糖特异性酶IIA组分(levD,SMU.1961c)的蛋白序列对戈登氏链球菌基因组序列进行BLAST搜索。鉴定出一个ORF,SGO_1893,注释为PTS系统的果糖(甘露糖)特异性IIA组分,是编码IIA组分(levD)以及果糖/甘露糖型渗透酶的IIB、IIC和IID结构域(分别由levE、levF和levG编码)的四基因操纵子中的第一个基因。预测levD基因编码一个145个氨基酸的多肽,与血链球菌、变形链球菌和乳房链球菌的果糖PTS IIA组分分别具有80%、68%和53%的同一性。同时还鉴定出一个葡萄糖/甘露糖特异性PTS IIAB组分(SGO_1679),命名为manL。预测戈登氏链球菌的manL基因编码一个329个氨基酸残基的多肽,与肺炎链球菌、血链球菌、唾液链球菌和变形链球菌的IIABMan基因分别具有94%、91%、87%和83%的同一性,并且是编码EIIMan渗透酶的IIC和IID组分的明显操纵子的一部分。
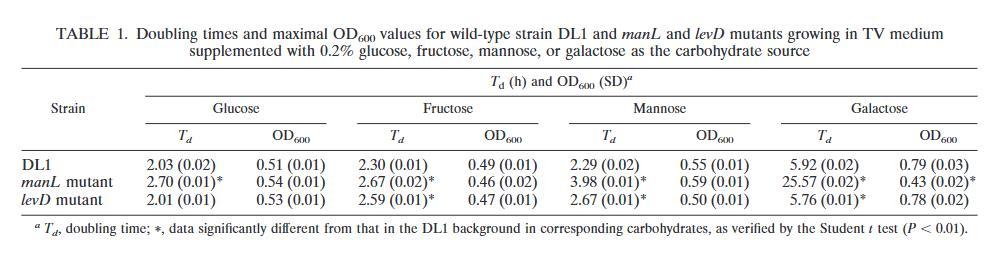
戈登氏链球菌manL和levD突变体的表征。为了评估manL和levD在戈登氏链球菌中的功能,使用非极性em盒在DL1株背景下构建了等位基因替换突变体。为了确定manL和levD在碳水化合物转运中的作用,使用Bioscreen C监测了野生型菌株以及manL和levD突变体在补充了0.2%葡萄糖、果糖、甘露糖或半乳糖的TV培养基中的生长。与野生型菌株相比,manL突变体在葡萄糖和甘露糖中的生长速率较慢,在半乳糖中显著减慢,但在果糖上仅略微减慢(表1),表明ManL可能参与戈登氏链球菌对葡萄糖、甘露糖和半乳糖的摄取。相反,levD突变体在存在果糖或甘露糖的情况下生长比DL1慢,这表明LevDEFG在这些己糖的转运中起作用。当在葡萄糖中生长时,野生型菌株和levD突变体之间的倍增时间没有显著差异。
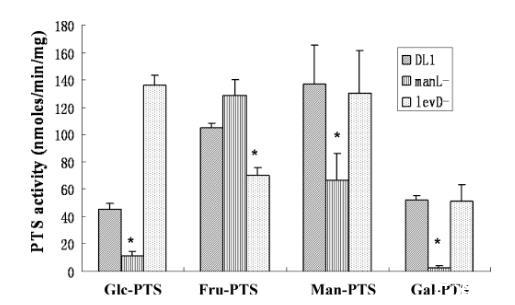
为了验证ManL和LevD在糖转运中的作用,将DL1以及manL和levD突变体在含有0.5%葡萄糖、果糖、甘露糖或半乳糖的TV中进行厌氧培养。在指数中期收集细胞,并分别使用葡萄糖、果糖、甘露糖或半乳糖作为底物测量PTS比活性。与DL1菌株相比,manL突变体对葡萄糖、甘露糖和半乳糖的PTS活性显著降低,但对果糖的活性略有增加。levD突变体对果糖的PTS活性显著降低,对葡萄糖的活性显著升高,而对甘露糖和半乳糖的PTS活性变化很小(图2)。这些结果进一步支持ManL参与葡萄糖、半乳糖和甘露糖的转运,并且可能也参与果糖的利用,而LevD似乎主要负责果糖的内化。
戈登氏链球菌fruA和levD基因的CCR。我们研究了fruA和levD的表达在转录水平上如何响应不同的碳水化合物进行调节。通过将含有fruA或levD启动子的DNA片段融合到整合载体上的无启动子cat基因,并将启动子融合以单拷贝形式建立在戈登氏链球菌染色体上的一个远端位点,构建了PfruA-cat和PlevD-cat融合体。用基因融合构建体转化DL1菌株,所得菌株在含有0.5%的葡萄糖、果糖、半乳糖或菊粉,或菊粉与葡萄糖、果糖或半乳糖组合的TV培养基中培养,然后进行CAT测定。如表2所示,当细胞在菊粉上生长时,fruA和levD启动子的活性最佳,但当细胞在偏好的碳水化合物葡萄糖或果糖上生长时较低。在含有菊粉和葡萄糖、半乳糖或果糖组合的细胞生长中,这些启动子融合的表达也受到抑制。因此,与变形链球菌中的同源系统相似,fruA和levD的转录可由果聚糖聚合物诱导,并在存在偏好碳水化合物时被抑制。值得注意的是,CCR在含有果糖的培养物中最明显,而变形链球菌中fruA的CCR由葡萄糖最有效地引发。同样值得注意的是,半乳糖引起fruA表达的明显抑制,但半乳糖在变形链球菌中基本上是一种非抑制性碳水化合物。
相关新闻推荐
1、贯叶连翘提取物通过诱导凋亡样死亡抑制藤黄微球菌生长(三)
2、鳜鱼多肽-锌螯合物对腐生葡萄球菌抑菌圈、过氧化氢酶活力、生长曲线的影响(三)
