1.3 改性葡聚糖包埋乳酸乳球菌体系的构建
参考本课题组以往方法并加以改进。LL 接种于8 mL MRS 液体培养基中,并置于37 ℃的恒温培养振荡器中培养过夜。培养结束后离心(6 000 r/min,4 min)获得菌泥,并用PBS 缓冲液洗涤菌泥2 次。随后将菌泥重悬于1 mL PBS 缓冲液中,备用。将100 μL 菌悬液(活菌数约为1×108 CFU/mL)、10 μL TA 溶液(40 mg/mL)和10 μL FeCl3 溶液(10 mg/mL)分别加入880 μL PBS 缓冲液中,涡旋60 s,使其在LL 表面形成牢固的金属-酚醛网络(Fe-TA)结构,获得LL@Fe-TA 体系。用PBS 缓冲液洗涤该体系2 次,以除去未反应的TA和Fe3+。将LL@Fe-TA 体系重悬于990 μL 的PBS缓冲液中,随后加入10 μL 不同质量浓度的mGN,使得mGN 在体系中最终质量浓度为0~0.2 mg/mL,并获得羧甲基化β-葡聚糖包埋乳酸乳球菌体系LL@Fe-TA@mGN。最后用PBS 缓冲液洗涤2 次,以除去体系中多余的mGN。
1.4 LL@Fe-TA@mGN 的粒径与电位分析
取1 mL 新鲜制备的LL@Fe-TA@mGN 稀释于9 mL 去离子水中,轻轻涡旋,使其充分分散于离心管中,使用激光粒度分析仪对LL@Fe-TA@mGN 的粒径与电位进行测定。
1.5 LL@Fe-TA@mGN 的生长曲线测定
将LL@Fe-TA@mGN 按照2%(体积分数)的接种量接种于新鲜的MRS 液体培养基中。将该体系置于37 ℃的恒温培养箱中,轻轻摇晃,以未接种的MRS 液体培养基作为空白组,未包埋的LL作为对照组。培养0,2,4,6,8,10,12 h 后,使用酶标仪测定菌株在波长600 nm 处的OD 值。
1.6 LL@Fe-TA@mGN 的微观形态分析
根据Feng等的方法,使用SEM 观察LL@Fe-TA@mGN 的表面形态。将MRS 液体培养基中的菌体样本离心(6 000 r/min,4 min)并去除上清液,用PBS 缓冲液洗涤3 次。随后将沉淀用2.5%的戊二醛溶液固定3 h。紧接着被固定的样本用PBS 缓冲液洗涤3 次,再用清水洗涤2 次。用体积分数30%,50%,70%,80%,90%的乙醇溶液连续对样本进行脱水,每次脱水15~20 min。之后用100%的乙醇溶液脱水2 遍,每次脱水15~20 min。使用干燥箱在40 ℃下对样品进行干燥10~15 min,随后进行喷金并上样观察。将1 滴细菌悬浮液小心地沉积在Formvar/carbon 200 目网格上并在空气中干燥,随后进行TEM 观察。
1.7 LL@Fe-TA@mGN 的胃液与胆盐耐受性研究
将等量LL 和LL@Fe-TA@mGN(1×109 CFU/mL)分别转移到1.6 mL 新鲜的模拟胃液中(Simulated gastric fluid,SGF;pH 2.5,1 000 mL 蒸馏水,5 g 胃蛋白酶,8.5 g NaCl)和4%胆汁盐中。然后,在37 ℃,200 r/min 的摇床条件下孵育。在预定时间点(0,1,2 h)取300 μL 反应溶液,离心(6 000 r/min,4 min)得到沉淀,并用PBS 缓冲液洗涤2 次。在连续稀释后,将获得的细菌悬液涂布在固体MRS 平板上。37 ℃孵育24 h 后,进行菌落计数。
1.8 LL@Fe-TA@mGN 的体内滞留成像
将10 只C57BL/6J 小鼠(禁食12 h)分为2组,分别口服Cy5 标记的LL@Fe-TA@mGN 和LL(1×109 CFU/mL)。使用活体成像系统在小鼠口服给药后预定时间点(4 h,8 h)获取小鼠活体胃肠道图像。
1.9 数据处理与分析
采用GraphPad Prism 8 进行统计分析,数据以“平均值±标准差”表示。统计学显著性分析采用单因素方差分析(ANOVA)。*:P <0.05;**:P <0.01;***:P <0.001;****:P <0.0001。
2 结果与分析
2.1 LL@Fe-TA@mGN 的粒径与电位
粒径与电位分析是验证益生菌包埋是否成功的重要手段。当使用具有不同电势的壁材包埋益生菌时,所得益生菌包埋体系的整体带电情况会发生相应改变。Anselmo等利用层层自组装的方法对芽孢乳酸菌进行包埋,未包埋的益生菌带有负电,包裹上一层壳聚糖后,体系变成正电,随后在最外层包裹上带负电的海藻酸钠,使体系的整体电势变成负电。Liu等也通过粒径与电位的变化来说明益生菌的包埋情况。本研究中,通过LL@Fe-TA@mGN 的粒径与电位分析,确定了LL的包埋情况与最外层mGN 的最佳使用剂量。如图1 和图2 所示,相对于未包埋的LL,LL@Fe-TA@mGN 的粒径与电位都有显著变化,说明mGN被金属-酚醛网络结构(Fe-TA)吸附在LL 的表面。当包埋LL 的mGN 质量浓度为0.12 mg/mL时,LL@Fe-TA@mGN 的粒径和zeta-电位都达到峰值,表明在该质量浓度下,单个LL 被mGN 完全包裹。
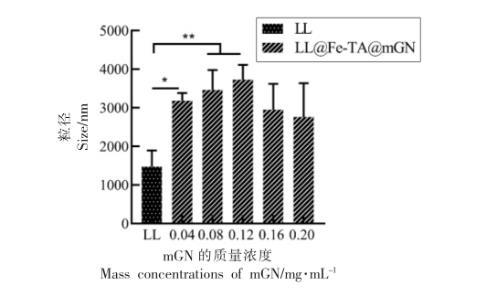
图1 包埋过程中使用的mGN 质量浓度(0~0.2 mg/mL)对LL@Fe-TA@mGN 粒径的影响
注:*.P <0.05;**.P <0.01。
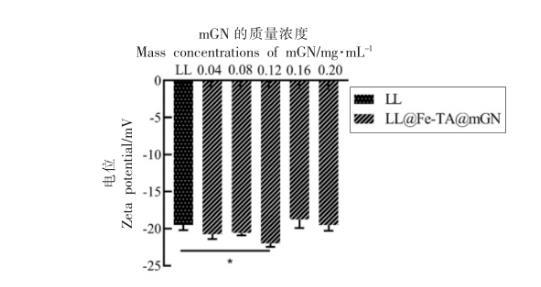
图2 包埋过程中mGN 质量浓度(0~0.2 mg/mL)对LL@Fe-TA@mGN zeta-电位的影响
注:*.P <0.05。
相关新闻推荐
1、肠道微生物群竟成抗癌“隐形战士”!催化生成新型胆汁酸激活抗肿瘤免疫(一)
2、微生物实验室基础操作指导(无菌室的要求、微生物实验结果报告)
3、桑椹菌核病拮抗菌的分离筛选、鉴定、生防作用与机理——结果与分析
