3.缺失株ΔvgrG的构建:
根据NCBI公布的Kpn vgrG ORF序列(NCBI Reference Sequence:NC_016845.1)设计引物,经PCR分别扩增vgrG上下游同源臂序列,再经过融合PCR扩增同源臂融合片段。回收纯化后的同源臂融合片段和质粒pKO3-Km分别用限制性内切酶NotⅠ进行酶切,再用T4连接酶进行连接,连接产物转化至大肠埃希菌DH5α感受态细胞中,经菌液PCR鉴定并测序正确。重组质粒pKO3-Km-vgrG转化入Kpn感受态细胞,经同源重组整合,筛选出构建成功的缺失株KpnΔvgrG。引物序列见表1,引物由苏州金唯智生物科技合成。
4.回补株CΔvgrG的构建:
根据NCBI的Kpn基因组序列扩增得到vgrG启动子及其全基因片段,经限制性内切酶KpnⅠ和SalⅠ对质粒pBAD33进行双酶切,将酶切后的载体与扩增片段通过同源重组酶连接,连接产物转化到大肠埃希菌DH5α感受态细胞中,经菌液PCR鉴定并测序正确。将重组质粒pBAD33-vgrG转入ΔvgrG株感受态细胞,涂板37℃培养至长出单菌落,经PCR鉴定含有重组质粒的菌株,即为回补株CΔvgrG。引物序列见表1,引物由苏州金唯智生物科技合成。
5.生长曲线试验:
将野生株WT、ΔvgrG株和CΔvgrG株的单菌落分别接种于15 ml LB培养基中,37℃200 r/min培养过夜,次日按1∶100转接至50 ml LB液体培养基中,37℃200 r/min振荡培养。每隔2 h测定菌液A 600值,连续检测24 h,每个时间点重复检测3次。使用软件GraphPad Prism 8.0绘制生长曲线。
6.沉淀离心试验(黏度试验):
挑取平板菌落至LB液体培养基中(CΔvgrG株培养基加入1.5%阿拉伯糖),37℃200 r/min培养至A 600值为2.0左右,5 000 r/min离心10 min(离心半径15 cm)后吸取上清测定A 600值,比较不同菌株上清的吸光度值以反映菌体黏度。
7.人肺上皮细胞A549黏附试验:
将2×10 5个A549细胞至24孔细胞板,贴壁后将培养至对数期的新鲜Kpn菌液按照MOI=20感染细胞5 h,PBS洗3次,0.5%Triton X-100裂解细胞,裂解液于LB平板培养,统计黏附的细菌克隆数。
8.小鼠巨噬细胞Raw264.7吞噬试验:
将Raw264.7细胞铺于12孔细胞板,细胞密度为5×10 5个/ml。将培养至对数期的Kpn WT株、ΔvgrG株和CΔvgrG株菌液按照MOI=20感染细胞,感染2 h后更换为含100μg/ml庆大霉素的DMEM培养1 h杀灭胞外菌,最后更换为含10μg/ml庆大霉素的DMEM继续培养6 h和12 h,0.5%Triton X-100裂解细胞,裂解液于LB平板培养,即为胞内存活的细菌克隆数。
9.小鼠存活率试验:
Kpn WT株、ΔvgrG株和CΔvgrG株以致死剂量1×10 8 CFU经鼻腔注射感染小鼠。感染后连续观察10 d,统计存活率。
10.小鼠脏器细菌载量试验:
Kpn WT株、ΔvgrG株和CΔvgrG株以半致死剂量(5×10 7 CFU)经鼻腔注射感染小鼠,感染后第3天收集肺脏并研磨,悬液中细菌通过倍比稀释进行计数。
11.统计学方法:
应用GraphPad Prism 8.0统计软件分析,符合正态分布的计量资料以±s表示,两组间比较采用t检验,采用线性回归进行相关分析,以P<0.05为差异有统计学意义。
结果
1.成功构建ΔvgrG株和CΔvgrG株:
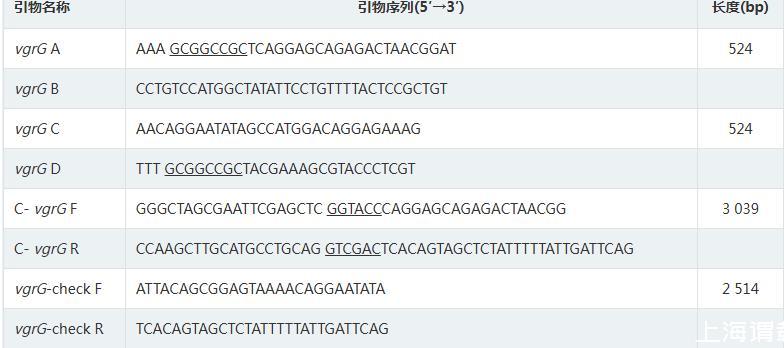
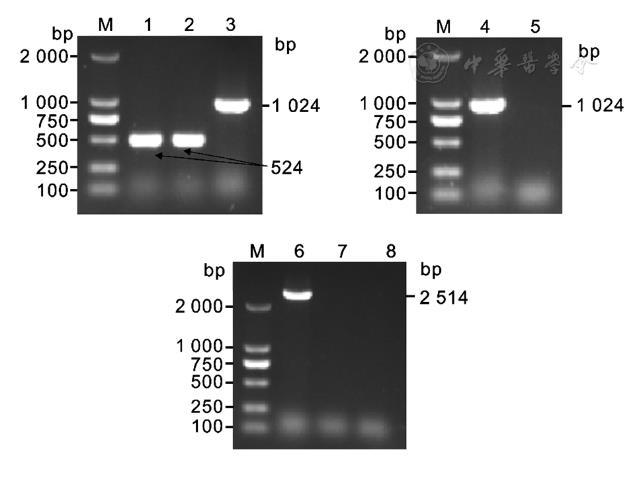
以高保真酶PCR扩增出vgrG的上游同源臂和下游同源臂,大小均为524 bp,拼接后连接至自杀载体。自杀载体pKO3-Km-vgrG导入Kpn WT株,经同源重组整合,获得了敲除vgrG的无痕缺失株。经特异性引物鉴定,WT株中存在vgrG而缺失株中无法扩增出vgrG序列(图1)。再以高保真酶PCR扩增出vgrG的启动子区域及完整开放阅读框,大小为3 039 bp,连接至表达载体pBAD33。将pBAD33-vgrG导入ΔvgrG感受态细胞。经特异性引物鉴定,CΔvgrG株构建成功(图2)。
vgrG同源臂扩增与ΔvgrG株PCR鉴定
注:M:DL2000 marker;1:上游同源臂;2:下游同源臂;3:上下游同源臂;4:pKO3-Km-vgrG载体鉴定;5:阴性对照;6:WT株;7:ΔvgrG株;8:阴性对照
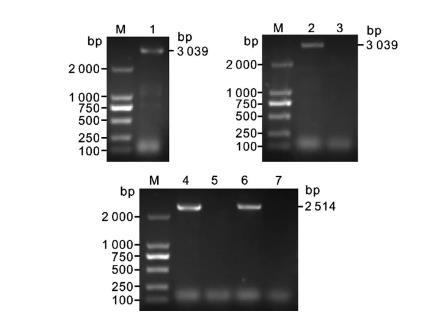
vgrG序列扩增与CΔvgrG株PCR鉴定
注:M:DL2000 marker;1:vgrG PCR扩增序列;2:pBAD33-vgrG载体鉴定;3:阴性对照;4:WT株;5:ΔvgrG株;6:CΔvgrG株;7:阴性对照
2.vgrG基因缺失后细菌的体外生长能力测定:
为观察vgrG是否对体外生长产生影响,每2 h用酶标仪测定不同菌株在LB培养基中的A 600值,测至细菌生长平台期。结果显示无论在对数期(4~8 h)还是最终的平台期(12 h以后),WT株和ΔvgrG株生长速度没有显著区别[(1.40±0.10)vs(1.20±0.30),t=0.63,P>0.05],ΔvgrG株和CΔvgrG株之间也没有显著区别(P>0.05)。以上结果表明vgrG不参与细菌的体外生长(图3A)。
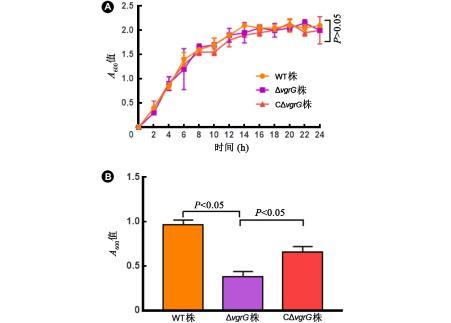
细菌体外生长曲线与黏度测定
注:A:细菌体外生长曲线;B:细菌离心后上清液吸光度(A)值
相关新闻推荐
1、产香酵母筛选、生长曲线、耐受性及与酿酒酵母混菌发酵果酒的感官评价——材料与方法
2、4抗生素对莱茵衣藻生长、光化学活性及其伴生细菌的抑制作用(二)
